
分析 断开化学键要吸收能量,形成化学键要放出能量;结合化学发应中能量变化的宏观表现分析.
解答 解:化学反应的实质是旧化学键的断裂和新化学键的形成,断开化学键要吸收能量,形成化学键要放出能量,因化学发应中能量变化的宏观表现是反应物总能量和生成物总能量不相等,若为放热反应,反应物总能量高于生成物总能量,若为吸热反应,应物总能量低于生成物总能量,所以一个化学反应时释放能量还是吸收能量取决于
反应物的总能量与生成物总能量的相对大小,所有的燃烧反应都是要释放能量;
故答案为:吸收能量;释放能量;反应物的总能量与生成物总能量的相对大小;放热反应;吸热反应;释放.
点评 本题主要考查了化学键的断开与形成与能量的关系、化学发应中能量变化的宏观表现,题目难度不大,注意把握化学变化的实质.


科目:高中化学 来源: 题型:选择题
| A. | 物质A的转化率增大了 | B. | 平衡向正反应方向移动 | ||
| C. | 物质C的体积分数增大了 | D. | a+b<c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
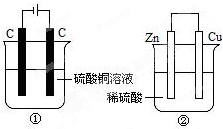 如图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole-,若不考虑溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole-,若不考虑溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积①=② | |
| B. | 溶液的pH变化:①减小②增大 | |
| C. | 电极上析出固体质量①<② | |
| D. | 电极反应式:①中阳极:Cu2++2e-═Cu②中负极Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
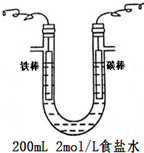 熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极助燃气,制得在650℃下工作的燃料电池,已知其电池反应相当于CO的燃烧,且负极反应式为2CO+2CO32--4e-=4CO2
熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极助燃气,制得在650℃下工作的燃料电池,已知其电池反应相当于CO的燃烧,且负极反应式为2CO+2CO32--4e-=4CO2查看答案和解析>>
科目:高中化学 来源: 题型:解答题
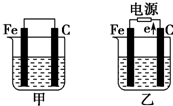 如图所示,甲、乙是电化学实验装置,请回答下列问题:
如图所示,甲、乙是电化学实验装置,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
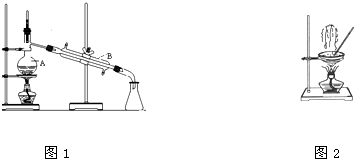 (1)如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(1)如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
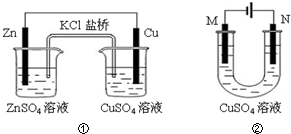
| A. | 装置①中盐桥内的K+移向ZnSO4溶液 | |
| B. | 若装置②中N极为铁棒,M极为石墨,则铁棒不易被腐蚀 | |
| C. | 若装置②用于铁棒镀铜,则M极为铁棒 | |
| D. | 若装置②用于电解精炼铜,则溶液中Cu2+浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com