
| 实验步骤 | 实验现象 |
分析 (1)生石灰加入沸水中,生成氢氧化钙,并放出大量的热;
(2)酚酞遇碱溶液变红色;
(3)纯碱与氢氧化钙反应生成NaOH可溶于水,且NaCl溶于水;
(4)若含碳酸钠,与盐酸反应生成气体;若含氢氧化钙,与碳酸钠反应生成白色沉淀;
(5)食醋,可以去除氨味和涩感,在溶液中醋酸与一水合氨反应生成醋酸铵和水;
(6)CaO+H2O=Ca(OH)2为化合反应、Ca(OH)2+Na2CO3=2NaOH+CaCO3↓为复分解反应,以此来解答.
解答 解:(1)生石灰加入沸水中,该化学反应的化学方程式为CaO+H2O=Ca(OH)2,水能持续保持沸腾,其原因是反应过程放热,
故答案为:CaO+H2O=Ca(OH)2;反应过程放热;
(2)静置后,取少量的上层料液,溶液显碱性,稀释后滴加无色酚酞试液,料液应变为红色,故答案为:红;
(3)纯碱与氢氧化钙反应生成NaOH可溶于水,且NaCl溶于水,则上层清液一定含有的溶质为NaOH、NaCl;不可能Ca(OH)2与Na2CO3同时存在,理由是Ca(OH)2+Na2CO3=2NaOH+CaCO3↓,
故答案为:NaOH、NaCl;Ca(OH)2+Na2CO3=2NaOH+CaCO3↓;
(4)可能含有的溶质为Na2CO3或Ca(OH)2,若含Na2CO3,取少量上层料液,滴加稀盐酸,有气泡产生;若含Ca(OH)2,取少量上层料液,滴加碳酸钠溶液,产生白色沉淀,故答案为:Na2CO3或Ca(OH)2;
| 实验步骤 | 实验现象 |
| 取少量上层料液,滴加稀盐酸(或取少量上层料液,滴加碳酸钠溶液) | 有气泡产生(产生白色沉淀) |
点评 本题考查物质的组成及含量的确定,为高频考点,把握物质的性质、发生的反应及实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | HCO3-,Cl-,Na+,NH4+ | B. | AlO2-,S2-,Na+,K+ | ||
| C. | SiO32-,CO32-,K+,Na+ | D. | Ba2+,Al3+,NO3-,Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti原子中均含有22个中子 | |
| B. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti在周期表中位置相同,都在第4纵行 | |
| C. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti的物理性质相同 | |
| D. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti为同一核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
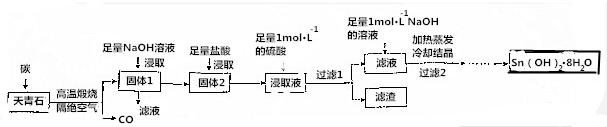
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
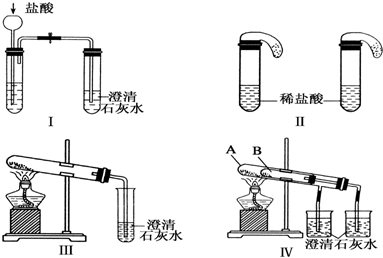
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 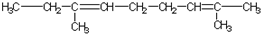 | B. | 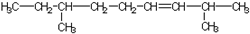 | ||
| C. | 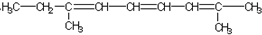 | D. | 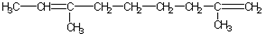 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的最简式:CH2═CH2 | |
| B. | Cl-的离子结构示意图: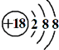 | |
| C. | 二氧化碳的电子式: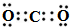 | |
| D. | 原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | |
| D. | 25℃、101kPa 下,Na2O2(s)+2 Na(s)═2Na2O(s)△H=-317kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com