
分析 (1)电解池中,有金属析出的电极是阴极,所以A是阴极,B是阳极,根据离子的放电顺序确定电极产物;
(2)根据铅蓄电池反应的化学方程式Pb+PbO2+2H2SO4=2PbSO4+2H2O结合电子转移情况进行计算;
(3)铅蓄电池放电时的化学方程式Pb+PbO2+2H2SO4=2PbSO4+2H2O,据此回答.
解答 解:(1)电解池中,有金属析出的电极是阴极,所以A是阴极,B是阳极,电解硝酸银,在阳极上是氢氧根离子失电子的氧化反应,产物是氧气,
故答案为:阴;氧气(或O2);
(2)铅蓄电池反应的化学方程式Pb+PbO2+2H2SO4=2PbSO4+2H2O,当反应过程中转移的电子为2mol时,铅蓄电池内消耗硫酸的物质的量为2mol,所以当反应过程中转移的电子为0.01mol时,铅蓄电池内消耗硫酸的物质的量为0.01mol,故答案为:0.01;
(3)铅蓄电池放电时的化学方程式Pb+PbO2+2H2SO4=2PbSO4+2H2O,消耗硫酸,所以电解液的pH增大,故答案为:增大.
点评 本题考查了电解原理的分析应用,主要是电极反应和电极判断,电子守恒是电化学计算的依据,掌握基础是关键,题目较简单.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | a molH2O和a molCO2所含分子数目相同 | |
| C. | 1mol氦气含有的氦原子物质的量是2mol | |
| D. | 摩尔是国际单位制中七个物理量之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 碳酸氢钠 | KAl(SO4)2•12H2O | FeSO4•7H2O | 氧化铁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用熟石灰可处理酸性废水 | B. | 焊锡(锡铅合金)熔点比金属锡高 | ||
| C. | 用丁达尔效应可区分溶液和胶体 | D. | 用热的纯碱溶液可清除油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
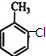
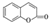 )是一种应用广泛的香料和药物中间体.以甲苯为原料生产香豆素流程如下:
)是一种应用广泛的香料和药物中间体.以甲苯为原料生产香豆素流程如下: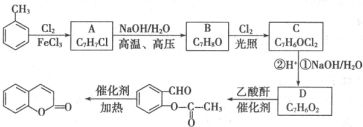
 ,D的结构简式是
,D的结构简式是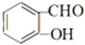 .
.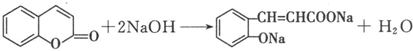 .
. .
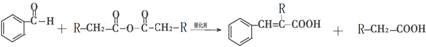
.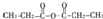 ,通过反应Ⅰ和反应Ⅱ,得到芳香化合物E,E的结构简式是
,通过反应Ⅰ和反应Ⅱ,得到芳香化合物E,E的结构简式是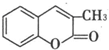 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com