

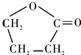
 ,据此解答.
,据此解答. ,
,| Ni |
| △ |
| Ni |
| △ |
 ,由E生成F的反应类型是:酯化反应,
,由E生成F的反应类型是:酯化反应, ;酯化反应;
;酯化反应;| △ |
| △ |


科目:高中化学 来源: 题型:
| A、K+、Na+、Cl-、CO32- |
| B、Cu2+、Cl-、Na+、SO42- |
| C、Ca2+、Na+、Cl-、NO3- |
| D、Na+、Ag+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质类别 | 含氧酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ② |
③NaOH ④ |
⑤Na2SO4 ⑥ |
⑦SO2 ⑧SO3 |
⑨NH3 ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液中加入铁粉:Fe3++Fe=2Fe2+ |
| B、氯气通入苦卤(海水晒盐后得到的母液)中:Br-+C12=Br2+C1- |
| C、硫酸溶液中滴加氢氧化钡溶液:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O |
| D、向烧碱溶液中滴加醋酸(CH3COOH):OH-+H+=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol N2参加氧化还原反应时电子转移数为3×6.02×1023 |
| B、16g O2所含氧原子个数为6.02×1023 |
| C、物质的量浓度为0.5 mol?L-1的MgCl2溶液,含有的Cl-数为6.02×1023 |
| D、常温常压下,22.4L SO2含分子的个数为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O |
| B、用烧碱溶液吸收氯气:Cl2+2OH-═Cl-+ClO-+H2O |
| C、二氧化氮与水反应:3NO2+H2O═NO+2H++2NO3- |
| D、氧化铝与氢氧化钠溶液反应:Al2O3+2OH-═AlO2-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com