
实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案:

请回答有关问题:
(1)甲方案:
①写出该反应的离子方程式______________;
②为了节约原料,硫酸和硝酸的物质的量之比最佳为n(H2SO4)∶n(HNO3)=__________。
(2)乙方案:将6.4 g铜丝放到90 mL 1.5 mol·L-1的稀硫酸中,控温在50 ℃。加入40 mL 10%的H2O2,反应0.5 h,升温到60 ℃,持续反应1 h后,经一系列操作,得CuSO4·5H2O 20.0 g[已知有关摩尔质量:M(Cu)=64 g·mol-1,M(CuSO4·5H2O) =250 g·mol-1]。
①反应时温度控制在50~60 ℃,不宜过高的原因是______________;
②本实验CuSO4·5H2O的产率为______________。
(3)丙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4,然后过滤、浓缩、结晶。
①物质A可选用以下的________(填序号);
A.CaO B.NaOH C.CuCO3
D.Cu2(OH)2CO3 E.Fe2(SO4)3
②反应中加入少量FeSO4可加速铜的氧化,FeSO4的作用是______________;
(4)对比甲、乙、丙三种实验方案,丙方案的优点有(写两条):____________________、__________________。
科目:高中化学 来源: 题型:
下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
B.化学反应速率为0.8 mol·L-1·s-1是1 s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象就越明显
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验装置进行的相应实验,能达到实验目的的是( )
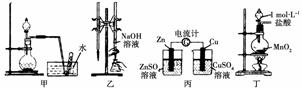
A.用图甲装置进行稀硝酸与铜的反应制取并收集NO
B.用图乙装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
C.用图丙装置检验电流的方向
D.用图丁装置制取少量Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
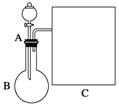 氨水是一种常用的化学试剂。
氨水是一种常用的化学试剂。
(1)以浓氨水和生石灰为原料,用如右装置为发生装置,可制取少量氨气。已知:NH3·H2O(浓)+CaO===Ca(OH)2+NH3↑。
①生石灰应该装在________(填“A”或“B”)中。
②试从电离平衡角度分析该实验中氨气逸出的原因:_______________。
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置。
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显。影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二:________________。
②请你设计实验验证上述影响因素一,完成下表中内容。
提供试剂:乙醛、2%稀氨水、0.25 mol·L-1 NaOH溶液、盐酸、2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
| 实验 步骤 | 实验操作 | 预期现象 及结论(步骤 1只填现象) |
| 1 | 在A、B两支洁净的试管中各加入1 mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至最初产生的沉淀恰好完全溶解,此时制得pH均约为8的银氨溶液 | |
| 2 |
(3)取20.00 mL上述氨水于锥形瓶,滴加3滴甲基橙指示剂,用0.005 0 mol·L-1 的标准硫酸溶液滴定,滴定至锥形瓶溶液出现红色为终点,重复3次实验,平均消耗标准硫酸20.04 mL,则上述氨水的物质的量浓度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于pH=12的Na2CO3溶液说法正确的是( )
A.升高溶液温度,溶液pH增大
B.c(Na+)+c(H+)=c(CO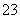 )+c(HCO
)+c(HCO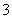 )+c(OH-)
)+c(OH-)
C.溶液中c(OH-)>c(HCO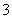 )>c(H+)
)>c(H+)
D.2c(Na+)=c(CO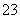 )+c(HCO
)+c(HCO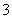 )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
制备Fe(OH)3胶体,下列操作方法能使之成功的是( )
A.把Fe2O3粉末放在水中加热至沸
B.氯化铁溶液中加少量氨水
C.把约30 mL蒸馏水加热至沸,滴入几滴浓氯化铁溶液
D.在约30 mL蒸馏水中加数滴氯化铁浓溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:
Ca(ClO)2+CaCl2+2H2SO4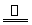 2CaSO4+2Cl2↑+2H2O。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O。他们设计了如下制取氯气并验证其性质的实验。
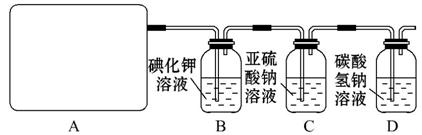
试回答:(1)该实验中A部分的装置是 (填写装置的序号)。
(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤): ___________________________________________________________________。
(3)若D中反应后的溶液具有漂白性,请写出D装置中发生反应的离子方程式___________________________________________________________________。
(4)该实验存在明显的缺陷,请你提出改进的方法______________________。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol·L-1的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2====Na2S4O6+ 2NaI反应完成时,共用去Na2S2O320.0 mL。则该漂白粉中Ca(ClO)2的质量分数为: _________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s) 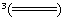 CuSO4(s)+5H2O(l), 热效应为△H
CuSO4(s)+5H2O(l), 热效应为△H 3。则下列判断正确的是
3。则下列判断正确的是
A.△H2> △H3 B.△H1<△H3
△H3 B.△H1<△H3
C.△H1+△H3 =△H2 D.△H1+△H2 >△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%。以下反应最符合绿色化学原子经济性要求的是 ( )
A.乙烯发生加聚反应制得聚乙烯高分子材料
B.用甲烷与氯气制备一氯甲烷
C.用苯和液溴为原料制取溴苯
D.用石灰石和稀盐酸反应制得二氧化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com