

分析 (1)①CO2(g)+2H2(g)?C(s)+2H2O(g)△H=-90.0kJ•mol-1
②H2O(1)═H2O(g)△H=+44.0kJ•mol-1
C(s)的燃烧热△H=-394.0kJ•mol-1,故热化学方程式为③C(s)+O2(g)=CO2(g)△H=-394.0kJ•mol-1
$\frac{1}{2}×①$+$\frac{1}{2}×$③-②得,H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286KJ/mol据此进行分析;
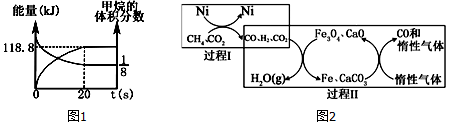
(2)①反应Ⅰ达到平衡状态后,随温度升高二氧化碳平衡转化率减小,说明正反应为放热反应;
②据影响平衡移动及化学反应快慢来分析;
③Kp=$\frac{p(C{H}_{4}){p}^{2}({H}_{2}O)}{p(C{O}_{2}){p}^{4}({H}_{2})}$进行计算;
④由图象得,为减少CO在产物中的比率,可采取的措施有降低温度或增加压强,据此进行分析;
(3)CH4与CO2其起始的物质的量浓度均为1.0 mol•L-1,且随着反应的进行,甲烷的浓度会越来越小,正反应速率也会越来越小,据此判断,根据图可知,反应平衡时图中对应的点应为A和F点,降温后,反应速率减小,平衡逆向移,甲烷的浓度会增大,CO浓度减小,据此判断.
解答 解:(1)①CO2(g)+2H2(g)?C(s)+2H2O(g)△H=-90.0kJ/mol
②H2O(1)═H2O(g)△H=+44.0kJ/mol
C(s)的燃烧热△H=-394.0kJ•mol-1,故热化学方程式为③C(s)+O2(g)=CO2(g)△H=-394.0kJ/mol
$\frac{1}{2}×①$+$\frac{1}{2}×$③-②得,H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286KJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286KJ/mol;
(2)①反应Ⅰ达到平衡状态后,随温度升高二氧化碳平衡转化率减小,说明正反应为放热反应,故<0;原因是反应Ⅰ达到平衡状态后,随温度升高二氧化碳平衡转化率减小,说明正反应为放热反应,
故答案为:<;反应Ⅰ达到平衡状态后,随温度升高二氧化碳平衡转化率减小,说明正反应为放热反应;
②温度过高或过低均不利于反应I的进行,原因是:温度过低,化学反应速率慢,温度过高反应Ⅰ向逆反应方向进行且CH4的选择性减小,
故答案为:温度过低,化学反应速率慢,温度过高反应Ⅰ向逆反应方向进行且CH4的选择性减小;
③CO2(g)+4H2(g)?CH4(g)+2H2O(g)
开始(n) 1 4 0 0
变化 0.8 3.2 0.8 1.6
平衡 0.2 0.8 0.8 1.6,则p(CO2)=$\frac{0.2}{0.2+0.8+0.8+1.6}$×0.1MPa=$\frac{1}{170}$MPa,p(H2)=$\frac{0.8}{0.2+0.8+0.8+1.6}$×0.1MPa=$\frac{4}{170}$MPa,p(CH4)=$\frac{0.8}{0.2+0.8+0.8+1.6}$×0.1MPa=$\frac{4}{170}$MPa,p(H2O)=$\frac{1.6}{0.2+0.8+0.8+1.6}$×0.1MPa=$\frac{8}{170}$MPa,则Kp=$\frac{p(C{H}_{4}){p}^{2}({H}_{2}O)}{p(C{O}_{2}){p}^{4}({H}_{2})}$=$\frac{\frac{4}{170}MPa×(\frac{8}{170}MPa)^{2}}{\frac{1}{170}MPa×(\frac{4}{170}MPa)^{4}}$=2.89×104(MPa)-2,
故答案为:2.89×104(MPa)-2;
④由图象得,为减少CO在产物中的比率,可采取的措施有降低温度或增加压强,
故答案为:降低温度或增加压强;
(3)CH4与CO2其起始的物质的量浓度均为1.0 mol•L-1,且随着反应的进行,甲烷的浓度会越来越小,正反应速率也会越来越小,所以曲线v正-c(CH4)相对应的是如图3中曲线是乙线;根据图可知,反应平衡时图中对应的点应为A和F点,降温后,反应速率减小,平衡逆向移动,甲烷的浓度会增大,所以此时曲线甲对应的平衡点可能为应为D点;降温后,反应速率减小,平衡逆向移动,CO浓度减小,曲线乙对应的平衡点可能为C点,
故答案为:乙;D;C.
点评 本题考查燃烧热化学方程式的书写,反应热的判断,平衡的移动,化学平衡常数的计算等,本题难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.20mol | B. | 0.40mol | C. | 0.42mol | D. | 0.60m |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度升高,反应速率增大,产率增大 | |
| B. | 增大反应物H2的浓度,HI%增大 | |
| C. | 增大压强,浓度增大,平衡不移动 | |
| D. | 使用催化剂,反应速率增大,I2的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属与非金属分界线附近的元素既有金属性,又有非金属性,称为过渡元素 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子组成的 | |
| C. | 118号元素是由自然界中元素衰变得到的 | |
| D. | 同种元素的不同核素之间互称同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol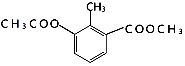 能与4molNaOH充分反应 能与4molNaOH充分反应 | |
| B. | 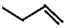 系统命名法为3-丁烯 系统命名法为3-丁烯 | |
| C. | 1mol 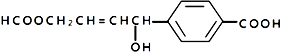 可以与4molH2发生加成 可以与4molH2发生加成 | |
| D. | 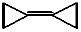 的碳原子都在一个平面内,且它的二氯代物为3种 的碳原子都在一个平面内,且它的二氯代物为3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
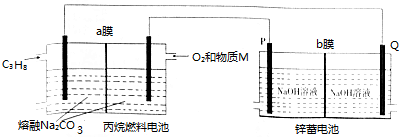
| A. | 物质M为CO2 | |
| B. | 燃料电池消耗1mo1 O2时,理论上有4 mol OH-透过b膜向P电极移动 | |
| C. | a膜、b膜均适宜选择阴离子交换膜 | |
| D. | 该装置中,锌蓄电池的正极反应式为Zn+2OH--2e-═ZnO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
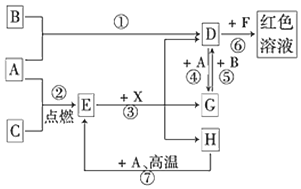
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
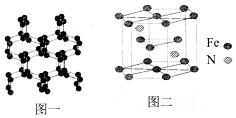 南京理工大学化工学院胡炳成教授团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破.请根据材料回答以下问题:
南京理工大学化工学院胡炳成教授团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破.请根据材料回答以下问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com