
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式,①-②×3得到所需热化学方程式;
(2)①据CO2(g)+3H2(g)?CH3OH(g)+H2O(g)此方程式,故k=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$;
②据v=$\frac{△c}{△t}$进行计算;
③用浓度计算此时浓度商Qc,与平衡常数比较判断反应进行方向;
④平衡常数K值增大即平衡向正反应方向移动或者平衡移动过程中逆反应速率先减小后增大.
解答 解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
依据盖斯定律①-②×3得到热化学方程式为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
(2)①据CO2(g)+3H2(g)?CH3OH(g)+H2O(g)此方程式,故k=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$;
故答案为:k=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$;
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)~△v=2mol
1 2
0.4 0.8
故△n(CO2)=0.4mol,υ(CO2)=$\frac{\frac{0.4mol}{2L}}{4min}$=0.05 mol•L-1•min-1,
故答案为:0.05 mol•L-1•min-1;
③此时浓度商Qc=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$=$\frac{\frac{1mol}{1L}×\frac{5mol}{1L}}{\frac{3mol}{1L}×(\frac{1mol}{1L})^{3}}$=$\frac{5}{3}>1$,故反应向逆反应进行,
故答案为:逆反应;
④平衡常数K值增大即平衡向正反应方向移动或者平衡移动过程中逆反应速率先减小后增大,
故答案为:ad.
点评 本题考查热化学方程式的书写,化学反应速率的计算,化学平衡的计算及移动,难度中等,注意掌握平衡常数的书写与用途.


科目:高中化学 来源: 题型:解答题
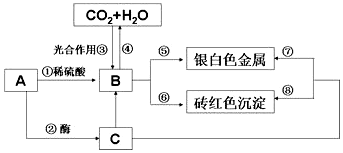
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
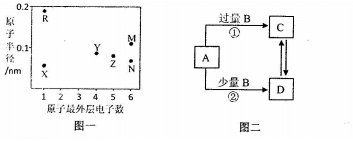
 .
. ,它能与双氧水在酸性条件下反应,生成两种无毒气体,其离子方程式为2CN-+5H2O2+2H+═N2↑+2CO2↑+6H2O.
,它能与双氧水在酸性条件下反应,生成两种无毒气体,其离子方程式为2CN-+5H2O2+2H+═N2↑+2CO2↑+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
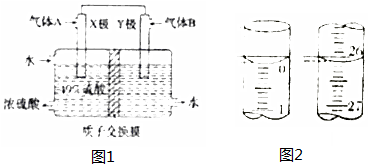
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时Li+由正极向负极移动 | |
| B. | M可能为羧酸、醇等含活泼氢的有机物 | |
| C. | 充电时的阳极反应为LixC-xe-=C+xLi+ | |
| D. | 钾离子电池的比能量(单位质量释放的能量)低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯乙烯属于芳香烃,也属于苯的同系物 | |
| B. | 相对分子质量相等的两种有机物必定是同分异构体 | |
| C. | 官能团相同的物质一定是同一类物质,例如含有苯环的烃都是芳香烃 | |
| D. | 由乙醇制备乙二酸二乙酯,发生的反应依次为消去、加成、取代、氧化、酯化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com