


科目:高中化学 来源: 题型:
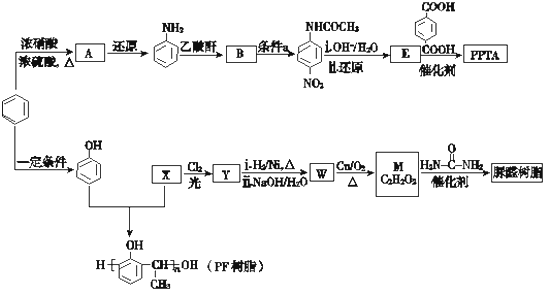
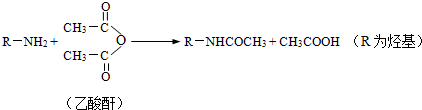
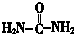 (尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子.
(尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子.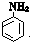 →B的反应类型是
→B的反应类型是查看答案和解析>>
科目:高中化学 来源: 题型:
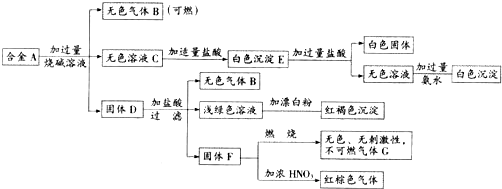
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油的分馏和裂化均属于化学变化 |
| B、乙醇、乙酸能用碳酸钠溶液、紫色石蕊溶液、酸性高锰酸钾溶液等多种方法鉴别 |
| C、油脂、塑料、天然橡胶都是高分子化合物 |
| D、因为葡萄糖在糖类结构中最简单,因此它是一种单糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用碘水鉴别苯、四氯化碳、乙醇三种无色液体 |
| B、取0.2mol NaCl固体于烧杯中,加入200 mL蒸馏水充分搅拌可配成1mol/L的NaCl溶液 |
| C、测定溶液的酸碱性时,应先将pH试纸润湿,然后进行检测 |
| D、为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
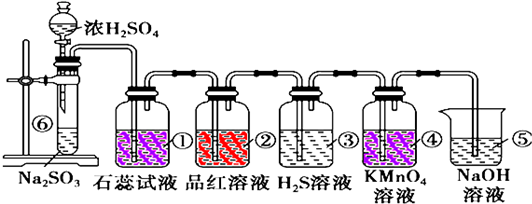
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当温度升高时,弱酸的电离平衡常数Ka变小 |
| B、某温度下的醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol/L |
| C、由Ksp(AgCl)>Ksp(AgI)可判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能发生 |
| D、常温下,pH=12氨水与pH=2盐酸等体积混合c(Cl-)>c(NH+4)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com