
分析 (1)氮是7号元素,最外层有5个电子,据此写价电子排布式;
(2)根据价层电子对互斥模型判断分子空间构型,根据中心原子价层电子对数判断杂化方式;氨气属于极性分子,易溶于极性溶剂,而且氨气与水能形成氢键,氨气与水反应生成一水合氨;
(3)含有孤电子对和含有空轨道的原子之间存在配位键;
(4)①若该反应中有4mol N-H键断裂,即有1molN2H4参加反应,生成1.5molN2,据此计算π键;
②根据硫酸铵中存在的化学键确定N2H6SO4晶体中存在的化学键.
解答 解:(1)氮是7号元素,最外层有5个电子,所以价电子排布式为2s22p3,故答案为:2s22p3;
(2)在NH3分子中,有3个N-H键,和一对孤电子对,根据价层电子对互斥模型判断分子空间构型为三角锥型;氨气属于极性分子,易溶于极性溶剂水中,而且氨气与水能形成氢键,氨气与水反应生成一水合氨,所以NH3极易溶于水;
故答案为:三角锥型;氨气是极性分子,与水分子形成氢键、与水反应;
(3)水分子或氨气分子中都存在极性键,Cu原子和水分子或氨气分子之间存在配位键,所以[Cu(H2O)6]2+和[Cu(NH3)4]2+中都含有配位键,极性共价键,故答案为:配位键和极性共价键;
(4)①反应中有4mol N-H键断裂,即有1molN2H4参加反应,生成1.5molN2,则形成的π键有3mol,
故答案为:3;
②N2H6SO4晶体类型与硫酸铵相同,可见它是离子晶体,晶体内存在离子键、配位键、极性共价键,肯定不存在范德华力,
故答案为:d.
点评 本题考查了原子轨道杂化方式、微粒空间构型的判断、物质的量的计算等知识点,根据价层电子对互斥理论、物质之间的反应等知识点来分析解答,易错点是(1),此处是价电子排布式不是电子排布式,很多同学审题不细心而导致错误,为易错点.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数 |
| CH3COOH | K=1.7×10-5 |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | H2CO3、HCO3-、CH3COO-、CN- | B. | HCO3-、CH3COOH、CN-、CO32- | ||
| C. | HCN、HCO3-、CN-、CO32- | D. | HCN、HCO3-、CH3COO-、CN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
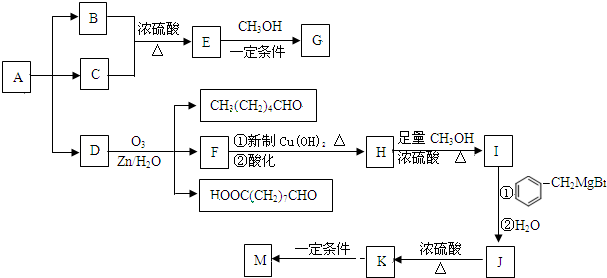
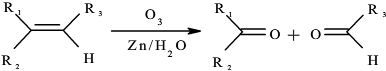
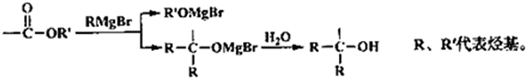
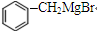 →
→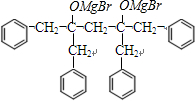 +2CH3OMgBr.
+2CH3OMgBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
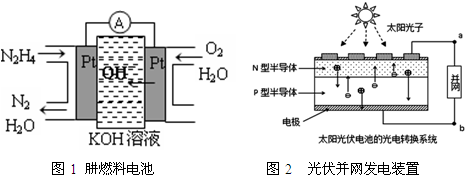
| A. | 氢氧燃料电池、太阳光伏电池中都利用了原电池原理 | |
| B. | 图1左边电极上发生的电极反应式为:N2H4-4e-+4OH-=N2+4H2O | |
| C. | 图2中N型半导体为正极,P型半导体为负极 | |
| D. | LED中的Ga和Y不可能都显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1盐酸和20.00mL 0.1000mol•L-1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1盐酸和20.00mL 0.1000mol•L-1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是( )| A. | 滴定盐酸的曲线是图乙 | |
| B. | 达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(X-) | |
| C. | 达到B、E状态时,反应消耗的,n(CH3COOH)>n(HCl) | |
| D. | 当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(X-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
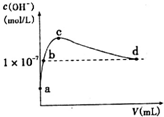 常温下,向l L pH=l0的NaOH溶液中持续通入CO2.通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述错误的是( )
常温下,向l L pH=l0的NaOH溶液中持续通入CO2.通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述错误的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 | |
| B. | b点溶液中:c(H+)=1×10-7mol•L-1 | |
| C. | c点溶液中:c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气液化以及液氨气化要吸热,所以氨常用于制冷剂 | |
| B. | 做红烧鱼时,常加一些食醋和料酒会更香,是因为生成少量的酯 | |
| C. | “地沟油”经过加工处理后可以用来制肥皂 | |
| D. | 利用生物方法脱除生活污水中的氮和磷,防止水体富营养化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NA个H2O | B. | 常温常压下,48g O2 | ||
| C. | 标准状况下,22.4L H2 | D. | 0.5mol CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com