
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2=Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |
分析 A.氯气与铁反应生成氯化铁,与反应物的量无关;
B.亚铁离子的还原性较强,氯气不足时亚铁离子优先反应,剩余的氯气再氧化溴离子;
C.2mol高锰酸根离子完全反应转化成锰离子得到10mol电子,能够氧化5mol双氧水,该反应不满足电子守恒;
D.n(Fe):n[HNO3(稀)]=1:3,介于3:8和1:4之间,反应生成亚铁离子和铁离子的混合物.
解答 解:A.Fe与氯气反应生成氯化铁,不会生成氯化亚铁,正确的化学方程式为:3Cl2+2Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,故A错误;
B.n(Cl2):n(FeBr2)=1:1,设二者各为1mol,1mol亚铁离子优先被氧化,消耗了0.5mol氯气,剩余的0.5mol氯气能够氧化1mol溴离子,则参与反应的亚铁离子和溴离子的物质的量相等,正确的离子方程式为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,故B错误;
C.高锰酸根离子与双氧水发生氧化还原反应,与反应物的量无关,正确的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,故C错误;
D.n(Fe):n[HNO3(稀)]=1:3,3mol稀硝酸与Fe反应生成硝酸铁时消耗Fe的物质的量为:3mol×$\frac{1}{4}$=0.75mol,剩余的0.25molFe能够还原0.5mol铁离子生成0.75mol亚铁离子,则反应生成亚铁离子和铁离子的物质的量之比=0.75mol:0.25mol=1:3,该反应的离子方程式为:4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O,故D正确;
故选D.
点评 本题考查了离子方程式计算与书写,为高考的高频题,题目难度中等,根据反应物的量正确判断反应产物为解答关键,试题培养了学生的分析能力及综合应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 用酸性KMnO4溶液可以检验绿矾(FeSO4•7H2O)是否变质 | |
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| C. | 在共价化合物分子内,可能存在离子键 | |
| D. | 在氮原子中,质子数为7而中子数不一定为7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属氧化物不一定是碱性氧化物 | |
| B. | HC1、H2S、NH3都是电解质 | |
| C. | 强酸强碱都是离子化合物 | |
| D. | FeBr3、FeCl2、CuS都不能直接用化合反应制备 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应均属于氧化还原反应 | |
| B. | 生成1 mol Cl2时,三个反应中转移的电子数相等 | |
| C. | 盐酸浓度越大,Cl-的还原性越强 | |
| D. | 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,D的简单气态氢化物的空间构型为三角锥形.
,D的简单气态氢化物的空间构型为三角锥形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 | |
| B. | 在25℃、101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,H2的燃烧热为-285.8kJ/mol | |
| C. | 在25℃、101kPa时,1molC与适量O2反应生成1molCO其它时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
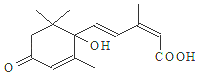 国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )
国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )| A. | 分子式C15H21O4 | |
| B. | 既能发生加聚反应,又能发生缩聚反应 | |
| C. | 1mol该物质与H2加成,最多消耗5molH2 | |
| D. | 既能使氯化铁溶液发生显色反应,又能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com