

 CO(g)+3H2(g)。该反应ΔH=+206 kJ·mol-1。
CO(g)+3H2(g)。该反应ΔH=+206 kJ·mol-1。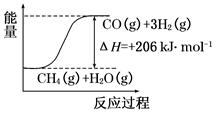


科目:高中化学 来源:不详 题型:填空题
| A.化学变化中的能量变化主要由化学键变化引起的 |
| B.放热反应发生时不一定要加热,但吸热反应必须要加热才能发生 |
| C.钢铁的吸氧腐蚀和析氢腐蚀的负极反应都为Fe—2e一= Fe2+ |
| D.CaCO3(s) =" CaO(s)" + CO2(g) ΔH=" +" 178.5 KJ·mol-1的意义是表示1mol CaCO3完全分解生成1mol CaO和1mol CO2气体要放出178.5 KJ的热量 |
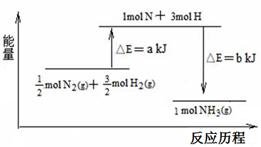
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
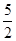 O2(g)=2CO2(g)+H2O(l) ΔH=-1300 kJ/mol 的说法中,正确的是( )
O2(g)=2CO2(g)+H2O(l) ΔH=-1300 kJ/mol 的说法中,正确的是( )| A.当转移10NA个电子时,该反应放出1300 kJ的能量 |
| B.当1NA个水分子生成且为液体时,吸收1300 kJ的能量 |
| C.当2NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
| D.当8NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.需要加热方能发生的反应一定是吸热反应 |
| B.若反应为放热反应,则该反应不必加热就可发生 |
| C.放热反应比吸热反应容易发生 |
| D.化学反应都伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,物质的量浓度均为0.1mol·L?1Na2CO3和NaHCO3的等体积混合溶液中: 2c(OH?)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32?) |
| B.ΔH<0,ΔS>0的反应都是自发反应,ΔH>0,ΔS>0的反应任何条件都是非自发反应; |
| C.已知:P4(g)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1 P4(g)+10Cl2(g)=4PCl5(g)ΔH=bkJ·mol-1 P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1,由此计算Cl-Cl键的键能 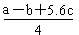 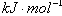 |
D.在一定温度下,固定体积为2L密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g) 2SO3(g) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2O(l) ΔH="-57.3" kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。其焓变ΔH1、ΔH2、ΔH3的关系是( )
H2O(l) ΔH="-57.3" kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。其焓变ΔH1、ΔH2、ΔH3的关系是( )| A.ΔH1>ΔH2>ΔH3 | B.ΔH1<ΔH3<ΔH2 |
| C.ΔH1=ΔH3>ΔH2 | D.ΔH1>ΔH3>ΔH2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
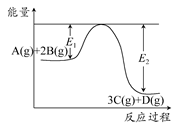
A.该反应热化学方程式为A(g)+2B(g)  3C(g)+D(g) ΔH>0 3C(g)+D(g) ΔH>0 |
| B.其他条件不变,升高温度,A的转化率增大 |
| C.其他条件不变,增大压强,释放热量减少,平衡常数K减小 |
| D.其他条件不变,加催化剂,反应速率增大,E1和E2均减小,ΔH不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com