
| A. | 常温下,1L0.1mol•L-1CuSO4溶液中含有的Cu2+数目为0.1NA | |
| B. | 含1molCl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液NH4+为NA | |
| C. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| D. | 25°C时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA |
分析 A、铜离子为弱碱阳离子,在溶液中会水解;
B、根据溶液的电中性来分析;
C、二氧化硫和氧气的反应为可逆反应,不能进行彻底;
D、pH=1的硫酸溶液中,氢离子浓度为0.1mol/L.
解答 解:A、铜离子为弱碱阳离子,在溶液中会水解,故溶液中的铜离子个数小于0.1NA个,故A错误;
B、根据溶液的电中性可知:n(Cl-)+n(OH-)=n(H+)+n(NH4+),而溶液显中性,故溶液中n(OH-)=n(H+),故有n(Cl-)=n(NH4+),即铵根离子为NA个,故B正确;
C、二氧化硫和氧气的反应为可逆反应,不能进行彻底,故2mol二氧化硫不能反应完全,则转移的电子数小于4NA个,故C错误;
D、pH=1的硫酸溶液中,氢离子浓度为0.1mol/L,故1L溶液中氢离子的个数为0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
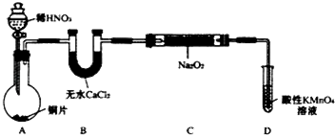
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
| 实验方案 | 实验现象 | 实验结论 |
| 取5mL 待测液,加入一定量的维生素C,振荡,再加入1mL M溶液,加入至蒸馏水10mL,再振荡, 与④号色阶对比. | 紫红色比④色阶浅 | 维生素C 可以有效降低NaNO2的含量. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质C和D的浓度相等 | |
| B. | 混合气体的平均相对分子质量不再变化 | |
| C. | A的物质的量浓度不再变化 | |
| D. | 物质B,C,D的物质的量之比为2:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.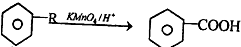
 是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
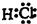 ;反应③中被破坏的化学键属于非极性键(填“极性”或“非极性”).
;反应③中被破坏的化学键属于非极性键(填“极性”或“非极性”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴离子具有氧化性 | B. | 氯气是还原剂 | ||
| C. | 该反应属于取代反应 | D. | 氯气的氧化性比溴单质强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
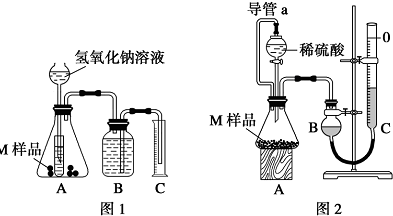
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
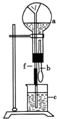 在图装置中,烧瓶中充满于燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )
在图装置中,烧瓶中充满于燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 4mol/L NaOH溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NH3 | CCl4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com