
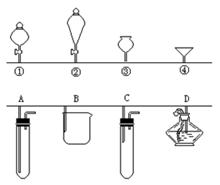
ČēĶ¼ÖŠµÄ¢Ł”¢¢Ś”¢¢Ū”¢¢Ü·Ö±šŹĒ¼øÖÖ³£¼ūĀ©¶·µÄÉĻ²æ£¬A”¢B”¢C”¢D·Ö±šŹĒŹµ¼Ź²Ł×÷£Ø·ÖŅŗ”¢ÖĘĘų”¢ĻņČŻĘ÷ÖŠ¼ÓŅŗĢåŹŌ¼ĮµČ£©Ź±£¬ø÷Ā©¶·µÄĻĀ²æ²åČėČŻĘ÷ÖŠµÄŹ¾ŅāĶ¼”£Ēėøł¾ŻŹµ¼ŹŹ¹ÓĆ²Ł×÷Ź±ÉĻŹöĀ©¶·µÄŹ¹ÓĆ·¶Ī§ŗĶĖüĆĒŠĪד£¬ĻĀĮŠÄÄŅ»ÖÖĘ„ÅäŹĒ²»ŗĻŹŹµÄ
A. Öʱø¶žŃõ»ÆĢ¼£ŗAÓė ¢Ū
B. ¹żĀĖ£ŗBÓė ¢Ü
C. ÓĆĖ«ŃõĖ®ŗĶ¶žŃõ»ÆĆĢÖĘŃõĘų£ŗCÓė ¢Ł
D. Ģķ¼Ó¾Ę¾«£ŗDÓė ¢Ś

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”°84Ļū¶¾Ņŗ”±ÄÜÓŠŠ§É±Ćš¼×ŠĶH1N1µČ²”¶¾£¬Ä³Ķ¬Ń§¹ŗĀņĮĖŅ»Ęæ”°ĶžĀ¶Źæ”±ÅĘ”°84Ļū¶¾Ņŗ"£¬²¢²éŌÄĻą¹Ų׏ĮĻŗĶĻū¶¾Ņŗ°ü×°ĖµĆ÷µĆµ½ČēĻĀŠÅĻ¢:”°84Ļū¶¾Ņŗ”±:ŗ¬25%NaClO”¢1000 mL”¢ĆܶČ1.192g”¤cm-3£¬Ļ”ŹĶ100±¶(Ģå»ż±Č)ŗóŹ¹ÓĆ”£

Ēėøł¾ŻŅŌÉĻŠÅĻ¢ŗĶĻą¹ŲÖŖŹ¶»Ų“šĻĀĮŠĪŹĢā:
(1)øĆ”°84Ļū¶¾Ņŗ”±µÄĪļÖŹµÄĮæÅضČĪŖ_________mol”¤L-1
(2)øĆĶ¬Ń§Č”100 mLĻ”ŹĶŗóµÄĻū¶¾ŅŗÓĆÓŚĻū¶¾£¬Ļ”ŹĶŗóČÜŅŗÖŠc(Na+)=_______________mol”¤L-1
(3)Ņ»Ęæ”°ĶžĀ¶Źæ”±ÅĘ”°84Ļū¶¾Ņŗ”±×ī¶ąÄÜĪüŹÕæÕĘųÖŠCO2_________L(±ź×¼×“æö)¶ų±äÖŹ”£
(4)øĆĶ¬Ń§²ĪŌÄ”°ĶžĀ¶Źæ”±ÅĘ”°84Ļū¶¾Ņŗ”±µÄÅä·½£¬ÓūÓĆNaClO¹ĢĢåÅäÖĘ480 mLŗ¬25% NaClOµÄĻū¶¾Ņŗ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ__________(Ģī±ąŗÅ)”£
A.ČēĶ¼ĖłŹ¾µÄŅĒĘ÷ÖŠ£¬ÓŠĖÄÖÖŹĒ²»ŠčŅŖµÄ£¬»¹ŠčŅ»ÖÖ²£Į§ŅĒĘ÷
B.ČŻĮæĘæÓĆÕōĮóĖ®Ļ“¾»ŗó£¬Ó¦ŗęøɲÅÄÜÓĆÓŚČÜŅŗÅäÖĘ
C.ĄūÓĆ¹ŗĀņµÄÉĢĘ·NaClOĄ“ÅäÖĘæÉÄܵ¼ÖĀ½į¹ūĘ«µĶ
D.ŠčŅŖ³ĘĮæµÄNaClO¹ĢĢåÖŹĮæĪŖ143 g
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻąĶ¬ĪĀ¶ČĻĀ£¬ŌŚĢå»żĻąµČµÄČżøöŗćČŻĆܱÕČŻĘ÷ÖŠ·¢ÉśæÉÄę·“Ó¦£ŗ
N2(g) £« 3H2(g)  2NH3(g) ”÷H£½£92.4 kJ/mol”£
2NH3(g) ”÷H£½£92.4 kJ/mol”£
ŹµŃé²āµĆĘšŹ¼£®Ę½ŗāŹ±µÄÓŠ¹ŲŹż¾ŻČēĻĀ±ķ£ŗ
| ČŻĘ÷±ąŗÅ | ĘšŹ¼Ź±ø÷ĪļÖŹĪļÖŹµÄĮæ/mol | Ę½ŗāŹ±·“Ó¦ÖŠµÄÄÜĮæ±ä»Æ | ||
| N2 | H2 | NH3 | ||
| ¢Ł | 1 | 3 | 0 | ·Å³öČČĮæa kJ |
| ¢Ś | 2 | 3 | 0 | ·Å³öČČĮæb kJ |
| ¢Ū | 2 | 6 | 0 | ·Å³öČČĮæc kJ |
ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
A£®·Å³öČČĮæ¹ŲĻµ£ŗa < b < 92.4 B£®ČżøöČŻĘ÷ÄŚ·“Ó¦µÄĘ½ŗā³£Źż£ŗ¢Ū > ¢Ł > ¢Ś
C£®Ę½ŗāŹ±°±ĘųµÄĢå»ż·ÖŹż£ŗ¢Ł > ¢Ū D£®N2µÄ×Ŗ»ÆĀŹ£ŗ¢Ś > ¢Ł > ¢Ū
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚŅ»¶ØĪĀ¶ČŗĶŃ¹ĒæĻĀ£¬ÓŠ1 molijĘųĢåA£¬·¢ÉśČēĻĀ·“Ó¦2A£Øg£© xB(g)+C(g)£¬µ±“ļµ½Ę½ŗāŹ±£¬AŌŚ»ģŗĻĘųÖŠµÄĢå»ż·ÖŹżĪŖ58.84%,»ģŗĻĘųµÄ×ÜÖŹĮæĪŖ46 g,Ę½¾łĻą¶Ō·Ö×ÓÖŹĮæĪŖ39.8,Ēó£ŗ
xB(g)+C(g)£¬µ±“ļµ½Ę½ŗāŹ±£¬AŌŚ»ģŗĻĘųÖŠµÄĢå»ż·ÖŹżĪŖ58.84%,»ģŗĻĘųµÄ×ÜÖŹĮæĪŖ46 g,Ę½¾łĻą¶Ō·Ö×ÓÖŹĮæĪŖ39.8,Ēó£ŗ
£Ø1£©AµÄ·Ö½āĀŹ£»
£Ø2£©xµÄÖµ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ
A. ½šŹōŃōĄė×ÓŅ»¶ØÖ»¾ßÓŠŃõ»ÆŠŌ
B. ½šŹōµ„ÖŹ×÷·“Ó¦ĪļŹ±Ņ»¶Ø²»ŹĒŃõ»Æ¼Į
C. Ńõ»Æ»¹Ō·“Ó¦ÖŠÓŠŅ»ÖÖŌŖĖŲ±»Ńõ»ÆŹ±£¬Ņ»¶ØÓŠĮķŅ»ÖÖŌŖĖŲ±»»¹Ō
D. Ńõ»Æ»¹Ō·“Ó¦ÖŠµÄ·“Ó¦Īļ£¬²»ŹĒŃõ»Æ¼Į¾ĶŹĒ»¹Ō¼Į
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
(NH4)2Cr2O7ŹĒŅ»ÖÖŹÜČČŅ×·Ö½āµÄŃĪ£¬ŌŚ·Ö½āµÄ¹ż³ĢÖŠ·¢ÉśĮĖŃõ»Æ»¹Ō·“Ó¦”£ĻĀĮŠø÷×é¶Ō(NH4)2Cr2O7ŹÜČČ·Ö½ā²śĪļµÄÅŠ¶Ļ£¬·ūŗĻŹµ¼ŹµÄŹĒ
A£®CrO3 £« NH3 £« H2O B£®Cr2O3 £«NH3 £« H2O
C£®CrO3 £« N2 £« H2O D£®Cr2O3 £«N2£« H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
µĒɽŌĖ¶ÆŌ±³£ĄūÓĆĒā»ÆøĘ¹ĢĢå×÷ĪŖÄÜŌ“Ģį¹©¼Į”£Ä³ŠĖȤŠ”×éÓĆ“æ¾»øÉŌļµÄĒāĘųŗĶ½šŹōøĘÖĘČ”Ēā»ÆøĘ£¬ĖłŃ”×°ÖĆĶ¼ČēĻĀ£ŗ


A B C D E
Ķ¼1
²éŌÄ׏ĮĻ£ŗ¢ŁøĘŅ×ÓėĖ®·“Ӧɜ³É¼īŗĶĘųĢ唣
¢ŚĒā»ÆøĘŅŖĆÜ·ā±£“ę£¬Ņ»µ©½Ó“„µ½Ė®¾Ķ·¢Éś·“Ӧɜ³ÉĒāŃõ»ÆøĘŗĶĒāĘų”£
£Ø1£©Ēė°“ĘųĮ÷·½ĻņĮ¬½ÓĖ³Šņi½Ó£Ø £©,£Ø £©½Ó£Ø £©,£Ø £©½Ó£Ø £©£¬k½Ó a
£ØĢīŅĒĘ÷½ÓæŚµÄ×ÖÄø±ąŗÅ£©”£
£Ø2£©×°ÖĆAµÄ×÷ÓĆŹĒ £»×°ÖĆCµÄ×÷ÓĆŹĒ ”£
£Ø3£©øł¾ŻĶźÕūµÄŹµŃé×°ÖĆ½ųŠŠŹµŃ飬ŹµŃé²½ÖčČēĻĀ£ŗ¼ģ²é×°ÖĆĘųĆÜŠŌŗó×°ČėŅ©Ę·£»“ņæŖ·ÖŅŗĀ©¶·»īČū£¬ £ØĒė°“ÕżČ·µÄĖ³ŠņĢīČėĻĀĮŠ²½ÖčµÄŠņŗÅ£©”£
¢Ł¼ÓČČ·“Ó¦Ņ»¶ĪŹ±¼ä ¢ŚŹÕ¼ÆĘųĢå²¢¼ģŃéĘä“æ¶Č
¢Ū¹Ų±Õ·ÖŅŗĀ©¶·»īČū ¢ÜĶ£Ö¹¼ÓČČ£¬³ä·ÖĄäČ“
£Ø4£©¼×Ķ¬Ń§Éč¼ĘŅ»øöŹµŃ飬²ā¶ØÉĻŹöŹµŃéÖŠµĆµ½µÄĒā»Æøʵēæ¶Č”£ĒėĶźÉĘĻĀĮŠŹµŃé²½Öč”£
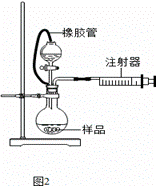 ¢ŁŃłĘ·³ĘĮæ ¢Ś¼ÓČė×ćĮæµÄ________ČÜŅŗ£ØĢī»ÆѧŹ½£©£¬½Į°č”¢¹żĀĖ ¢Ū_______”¢________£ØĢī²Ł×÷Ćū³Ę£© ¢Ü³ĘĮæĢ¼ĖįøʵÄÖŹĮæ
¢ŁŃłĘ·³ĘĮæ ¢Ś¼ÓČė×ćĮæµÄ________ČÜŅŗ£ØĢī»ÆѧŹ½£©£¬½Į°č”¢¹żĀĖ ¢Ū_______”¢________£ØĢī²Ł×÷Ćū³Ę£© ¢Ü³ĘĮæĢ¼ĖįøʵÄÖŹĮæ
£Ø5£©ŅŅĶ¬Ń§ĄūÓĆĶ¼2×°ÖĆ²ā¶ØÉĻŹöŹµŃéÖŠµĆµ½µÄĒā»Æøʵēæ¶Č”£Ėū³ĘČ”46 mg ĖłÖʵƵÄĒā»ÆøĘѳʷ£¬¼ĒĀ¼æŖŹ¼Ź±×¢ÉäĘ÷»īĖØĶ£ĮōŌŚ10.00 mLæĢ¶Č“¦£¬·“Ó¦½įŹųŗó³ä·ÖĄäČ“£¬»īĖØ×īÖÕĶ£ĮōŌŚ57.04 mLæĢ¶Č“¦”££ØÉĻŹöĘųĢåĢå»ż¾łŌŚ±ź×¼×“æöĻĀ²ā¶Ø£©
ŹŌĶعż¼ĘĖćĒóѳʷ֊Ēā»Æøʵēæ¶Č£ŗ ”££Ø¼ĘĖć½į¹ū±£ĮōŅ»Ī»Š”Źż£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŠĀŠĶČ¼ĮĻÖš½„Č”“ś“«Ķ³Č¼ĮĻŌŚ¹¤ŅµÉś²śŗĶ¹ś·Ą½ØÉčÖŠ¹ć·ŗÓ¦ÓĆ£¬»Ų“šĻĀĮŠĪŹĢā£ŗ””
£Ø1£©ŅŃÖŖĻĀĮŠČČ»Æѧ·½³ĢŹ½£ŗ
2H2(g)+O2(g)==2H2O(g) ”÷H=£483.6 KJ.mol-1
H2O(l)==H2O(g) ”÷H=£«44 KJ.mol-1
ŌņĒāĘųµÄ±ź×¼Č¼ÉÕČČ ”ų £¬ĒāĘųČČÖµ ”ų ”£
£Ø2£©0.3molĘųĢ¬øßÄÜČ¼ĮĻŅŅÅšĶé£ØB2H6£©ŌŚŃõĘųÖŠČ¼ÉÕ£¬Éś³É¹ĢĢ¬ČżŃõ»Æ¶žÅšŗĶŅŗĢ¬Ė®£¬·Å³ö649.5kJµÄČČĮ攣Š“³öøĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ ”ų ”£
(3)ėĀæÉ×÷ĪŖ»š¼ż·¢¶Æ»śµÄČ¼ĮĻ£¬ÓėŃõ»Æ¼ĮN2O4·“Ӧɜ³ÉN2ŗĶĖ®ÕōĘų”£
ŅŃÖŖ£ŗ¢ŁN2(g)+2O2(g)= N2O4 (1)”””””””÷H1= -195kJ”¤mol-1””
”””” ¢Ś N2H4(1) + O2(g)= N2(g) + 2H2O£Øg£©”””””÷H2= -534.2kJ”¤mol-1
Š“³öėĀŗĶN2O4·“Ó¦µÄČČ»Æѧ·½³ĢŹ½”””””””””””””””””” ”ų ”””””””””””””””””””£
(4)ėĀŅ»æÕĘųČ¼ĮĻµē³ŲŹĒŅ»ÖÖ¼īŠŌµē³Ų£¬øƵē³Ų·ÅµēŹ±£¬øŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖ”””””ų ”””” ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²ŻŅ©ŻŹõøł¾„ÖŠŗ¬ÓŠŅ»ÖÖÉ«ĖŲ£¬ĖüµÄ½į¹¹¼ņŹ½ĪŖCH2£(CO£CH£½CH£ £OH)2ÓĆĖüÖĘ³ÉµÄŹŌÖ½æÉŅŌ¼ģŃéČÜŅŗµÄĖį¼īŠŌ”£Äܹ»øś1 moløĆ»ÆŗĻĪļĘš·“Ó¦µÄBr2Ė®ČÜŅŗ»ņH2µÄ×ī“óÓĆĮæ·Ö±šŹĒ£Ø ””£©
£OH)2ÓĆĖüÖĘ³ÉµÄŹŌÖ½æÉŅŌ¼ģŃéČÜŅŗµÄĖį¼īŠŌ”£Äܹ»øś1 moløĆ»ÆŗĻĪļĘš·“Ó¦µÄBr2Ė®ČÜŅŗ»ņH2µÄ×ī“óÓĆĮæ·Ö±šŹĒ£Ø ””£©
A£®3 mol 3 mol B£®3 mol 5 mol C£®6 mol 6 mol D£® 6 mol 10 mol
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com