
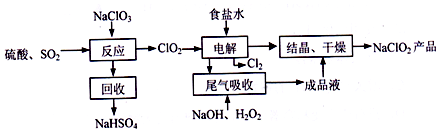
分析 由制备流程可知,NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO3是氧化剂,回收产物为NaHSO4,说明生成硫酸氢钠,且产生ClO2,根据电子守恒可知,此反应的化学方程式为2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2,选择NaOH除去食盐水中的Mg2+,选择碳酸钠除去食盐水中的Ca2+,然后电解装置中阴极ClO2得电子生成ClO2-,阳极Cl-失电子生成Cl2,含过氧化氢的氢氧化钠溶液吸收ClO2,产物为ClO2-,最后NaClO2溶液结晶、干燥得到产品,以此来解答.
解答 解:(1)“反应”步骤中生成ClO2的化学方程式为2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2,
故答案为:2NaC1O3+SO2+H2SO4=2ClO2+2NaHSO4;
(2)由分析可知电解装置中阴极ClO2得电子生成ClO2-,阳极Cl-失电子生成Cl2,
故答案为:ClO2-(或 NaC1O2);
(3)食盐溶液中混有Mg2+ 和Ca2+,可以利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+,
故答案为:NaOH;Na2CO3;
(4)含过氧化氢的氢氧化钠溶液吸收ClO2,“尾气吸收”的离子方程式为2ClO2+2OH-+H2O2=2C1O2-+O2+2H2O,此反应中ClO2为氧化剂,H2O2为还原剂,氧化剂和还原剂的物质的量之比为2:1,
故答案为:2ClO2+2OH-+H2O2=2C1O2-+O2+2H2O;2:1;
(5)1gNaClO2的物质的量$\frac{1g}{90.5g/mol}$=$\frac{1}{90.5}mol$,依据电子转移数目相等,NaClO2~Cl-~4e-,Cl2~2Cl-~2e-,可知氯气的物质的量为$\frac{1}{90.5}×4×\frac{1}{2}$mol=$\frac{2}{90.5}$mol,则氯气的质量为$\frac{2}{90.5}mol×$×71g/mol=1.57g,
故答案为:1.57.
点评 本题考查了物质制备的实验方法分析、氧化还原反应概念分析和电子转移的计算、注意物质性质的理解应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 容器内压强p p甲=p丙>2p乙 | |
| B. | SO3的质量m m甲=m丙<2m乙 | |
| C. | c(SO2)与c(O2)之比k k甲=k丙>2k乙 | |
| D. | 反应放出或吸收热量的数值Q Q甲=197-Q丙>2Q乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

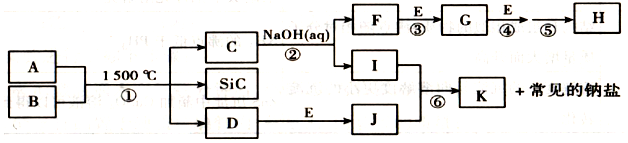
 ,G的化学式:NO;
,G的化学式:NO;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 氯化镁溶液中加入氢氧化钠溶液:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 铝片放入过量浓NaOH溶液:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 将铜片放入过量稀HNO3溶液中:3Cu+8HNO3═3Cu2++6NO3-+2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
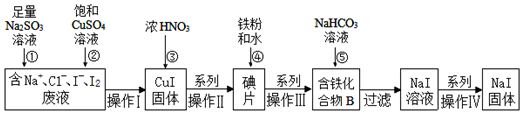
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
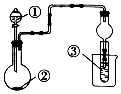 利用如图装置进行下列实验,一定不能得出相关实验现象的是( )
利用如图装置进行下列实验,一定不能得出相关实验现象的是( )| 选项 | ① | ② | ③ | ④ |
| A | 醋酸水溶液 | 贝壳 | 澄清石灰水 | 先浑浊后澄清 |
| B | 稀盐酸 | 石灰石 | 饱和Na2CO3溶液 | 出现浑浊 |
| C | 浓盐酸 | 浓硫酸 | 石蕊溶液 | 出现红色 |
| D | 浓盐酸 | Na2CO3 | CaCl2溶液 | 先浑浊后澄清 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com