��2013?����һģ����������Դ��ʹ�����ȼ�ϣ����Դﵽ�����Ч��������Ⱦ��Ŀ�ģ�
��1����C��H��O����Ԫ���е����ֺ����ֱַ���ɵ�ȼ�����ʼ��ң�������о���������1���ҷ����к���18�����ӣ�����ҷֱ���
CO��CH3OH
CO��CH3OH
��
����һ�����ȼ�ϣ���ҵ�Ͽ��ü�������Ӧ�Ƶã�
��T
1�¶�ʱ�������Ϊ2L���ܱ������г���2mol��6mol H
2����Ӧ�ﵽƽ����c���ף�=0.2mol/L��������ƽ�������е����ʵ���������
��
�������¶ȵ�T
2ʱ����Ӧ��ƽ�ⳣ��Ϊ1�����д�ʩ�������ת���ʵ���
C
C
������ĸ����
A������2mol�� B�����뵪�� C��������� D�������¶�
��2������Ҳ��һ�����ȼ�ϣ�������ȫȼ��ʱ��Ч�ʽ��Ͳ�������ж����������Ⱦ��
��֪��
CH
4��g��+2O
2��g��=CO
2��g��+2H
2O��l����H
1=-890.3kJ/mol
2CO ��g��+O
2��g��=2CO
2��g����H
2=-566.0kJ/mol
����鲻��ȫȼ������һ����̼��Һ̬ˮʱ����Ч��ֻ����ȫȼ��ʱ��
0.7
0.7
��������������1λС������
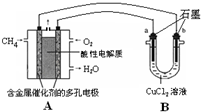
��3������ȼ�ϵ�ؿ����������������ʣ���ͼ�����ü���ȼ�ϵ�ص��50mL 2mol/L���Ȼ�ͭ��Һ��װ��ʾ��ͼ��
��ش�
�ټ���ȼ�ϵ�صĸ�����Ӧʽ��
CH4-8e-+2H2O=CO2+8H+
CH4-8e-+2H2O=CO2+8H+
��
�ڵ���·����0.1mol����ͨ��ʱ��
b
b
���a����b����������
0.32
0.32
g��

 ��2013?����һģ����������Դ��ʹ�����ȼ�ϣ����Դﵽ�����Ч��������Ⱦ��Ŀ�ģ�
��2013?����һģ����������Դ��ʹ�����ȼ�ϣ����Դﵽ�����Ч��������Ⱦ��Ŀ�ģ�

 ����ѧ��Ӧ�����ϵ�д�
����ѧ��Ӧ�����ϵ�д�