将10g铁置于40mL某浓度的硝酸中,再微热充分反应后,共收集到NO,NO2混合气体1792mL,溶液里还残留4.4g固体(标准状况).求:
(1)NO的体积为______mL,NO2的体积为______mL.
(2)则原硝酸溶液的浓度为______mol/L.
(3)欲使铁与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要质量分数为30%的双氧水______g.(保留一位小数)
解:最后溶液中尚余4.4g固体,该固体是铁,则溶液中铁以亚铁离子存在,即溶液中的溶质是硝酸亚铁,反应至结束共收集到气体1792mL气体(均为标况下测定,不考虑N
2O
4存在),混合气体的物质的量=

=0.08mol,反应消耗铁的物质的量=
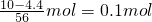
,
(1)设n(NO)是xmol,n(NO
2)是ymol,结合转移电子守恒列方程组为:
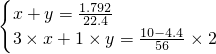
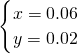
则V(NO)=0.06mol×22.4L/mol=1.344L=1344mL,
V(NO
2)=0.02mol×22.4L/mol=0.488L=488mL,
故答案为:1344;448;
(2)无论是二氧化氮还是一氧化氮,n(NO
x)=n(HNO
3)(作氧化剂),n[Fe(NO
3)
2]=

n(HNO
3)(作酸),根据氮原子守恒,硝酸的物质的量=n(NO
x)+2n[Fe(NO
3)
2]=0.08mol+0.1mol×2=0.28mol,
C(HNO
3)=
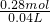
=7 mol/L,
故答案为:7;
(3)反应生成NO 0.06mol,NO
2 0.02mol,欲使铁与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO
3,
则二者共失去电子0.06mol×(5-2)+0.02mol×(5-1)=0.2mol,
双氧水的电子应为0.2mol,则需双氧水0.1mol,
m(H
2O
2)=34g/mol×0.1mol=3.4g,
则至少需要质量分数为30%的双氧水为

=11.3g,
故答案为:11.3.
分析:(1)根据氮原子守恒及得失电子数相等列方程组解出一氧化氮和二氧化氮的物质的量;
(2)根据氮原子守恒计算硝酸的物质的量浓度;
(3)根据得失电子守恒计算.
点评:本题考查了氧化还原反应的计算,明确铁和硝酸反应过程中发生的反应是解本题的关键,注意铁先和硝酸反应生成硝酸铁,然后铁再和硝酸铁反应生成硝酸亚铁,再结合原子守恒、得失电子守恒来分析解答即可,难度较大.

 =0.08mol,反应消耗铁的物质的量=
=0.08mol,反应消耗铁的物质的量=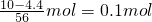 ,
,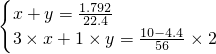
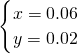
 n(HNO3)(作酸),根据氮原子守恒,硝酸的物质的量=n(NOx)+2n[Fe(NO3)2]=0.08mol+0.1mol×2=0.28mol,
n(HNO3)(作酸),根据氮原子守恒,硝酸的物质的量=n(NOx)+2n[Fe(NO3)2]=0.08mol+0.1mol×2=0.28mol,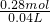 =7 mol/L,
=7 mol/L, =11.3g,
=11.3g,

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案