
有A、B、C、D、E和F六瓶无色溶液,它们都是中学化学中常用的无机试剂。E的溶质是一种无色油状液体;B、C、D和F是盐溶液,且它们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;②将A分别加入其他五种溶液中,只有D、F中有沉淀产生,继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。根据上述实验信息,下列说法错误的是
A.B可能是NaHCO3溶液
B.F为AgNO3溶液
C.D不可能是镁或铝的盐酸盐
D.A为氨水,E为硫酸
A
【解析】由题干表述可知A和E不是盐,又由E为无色油状液体,推知E为浓硫酸(③步操作进一步确定);由题干和①步操作可知A为氨水;再由②步操作可知F中阳离子为Ag+,发生的反应为Ag++NH3·H2O=AgOH↓+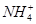 ,AgOH+2NH3·H2O=[Ag(NH3)2]+OH-+2H2O,而常见的银盐中只有AgNO3可溶于水,故F为AgNO3;由③步操作可知盐B与E(H2SO4)放出的无色无味的气体只能是CO2,所以B中阴离子应为
,AgOH+2NH3·H2O=[Ag(NH3)2]+OH-+2H2O,而常见的银盐中只有AgNO3可溶于水,故F为AgNO3;由③步操作可知盐B与E(H2SO4)放出的无色无味的气体只能是CO2,所以B中阴离子应为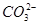 或
或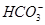 ,C、D、F生成沉淀说明应该是
,C、D、F生成沉淀说明应该是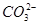 ,而阳离子可以是常见的K+、Na+、
,而阳离子可以是常见的K+、Na+、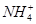 等待定;同样由②步操作知,能与氨水生成沉淀的无色溶液中常见的阳离子为Mg2+或Al3+,由于题中只说B(含
等待定;同样由②步操作知,能与氨水生成沉淀的无色溶液中常见的阳离子为Mg2+或Al3+,由于题中只说B(含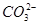 )与D生成沉淀,并没指出有无气体,所以D可能含Mg2+,也可能含Al3+,D的阴离子在此处不能确定;由④步知C与D、E(H2SO4)、F(AgNO3)生成不溶于HNO3的沉淀,所以C必为BaCl2;进而推出D中阴离子应该为SO,故D为Al2(SO4)3或MgSO4。
)与D生成沉淀,并没指出有无气体,所以D可能含Mg2+,也可能含Al3+,D的阴离子在此处不能确定;由④步知C与D、E(H2SO4)、F(AgNO3)生成不溶于HNO3的沉淀,所以C必为BaCl2;进而推出D中阴离子应该为SO,故D为Al2(SO4)3或MgSO4。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.1弱电解质的电离试卷(解析版) 题型:选择题
下列各组物质中,都是强电解质的是( )
A.HBr、HCl、BaSO4
B.NH4Cl、CH3COOH、Na2S
C.NaOH、Ca(OH)2、NH3·H2O
D.HClO、NaF、Ba(OH)2
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学铜及其化合物主要性质、合金(解析版) 题型:填空题
铜单质及其化合物是应用极其广泛的物质。
(1)铜是氢后金属,不能与盐酸发生置换反应,但将单质铜置于浓氢碘酸中,会有可燃性气体及白色沉淀生成,又知氧化性:Cu2+>I2,则铜与氢碘酸反应的化学方程式为__________________________________
(2)已知Cu2O能溶于醋酸溶液或盐酸中,同时得到蓝色溶液和红色固体,则Cu2O与稀硫酸反应的离子方程式为____________________________________;
Cu2O与稀硝酸反应的离子方程式为_____________________________;
只用稀硫酸来确定某红色固体是 Cu2O与Cu组成的混合物的方法:称取m g该红色固体置于足量稀硫酸中,充分反应后过滤,然后___________________。
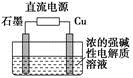
(3)Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解装置如图所示,电解总反应:2Cu+H2O Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。
Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。
(4)现向Cu、Cu2O、CuO组成的混合物中加入1 L 0.6 mol/L HNO3恰好使混合物溶解,同时收集到2 240 mL NO(标准状况)。若将上述混合物用足量的氢气还原,所得固体的质量为________;若混合物中含有0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗硫酸的物质的量为________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学铁及其化合物主要性质(解析版) 题型:选择题
下列有关金属及其化合物的说法正确的是
A.Mg和Al都可以用电解法冶炼得到
B.Na2O2、Na2O组成元素相同,与CO2反应产物也相同
C.用过量的KSCN溶液除去FeCl2溶液中的少量FeCl3
D.Mg和Fe在一定条件下与水反应都生成H2和对应的碱
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学钠及其化合物主要性质(解析版) 题型:选择题
常温常压下过氧化钠可与CO2反应,与CO不反应。现将CO2、CO的混合气体在一定条件下和足量过氧化钠充分反应后,若固体质量增加了28 g,下列说法正确的是
A.反应过程中,电子转移数为2NA
B.固体生成物的质量为106 g
C.CO可能有剩余
D.反应后一定生成11.2 L氧气
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学速率表示与平衡移动(解析版) 题型:实验题
某化学小组设计如图实验装置
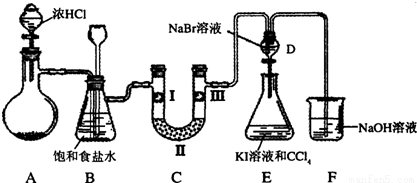
(1)若装置A中的固体药品为KClO3,则写出离子方程式 。
(2)装置B既能除去氯气中的氯化氢,还能检测实验过程中装置C是否发生堵塞。若C中发生堵塞,B中将观察到的现象是 。
(3)装置C的作用是验证氯气是否具有漂白性,l处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是 , 。
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。请简述能说明氯、溴、碘非金属性强弱的实验操作及现象 。(夹持装置略去)制备Cl2并探究氯气的相关性质:
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学速率表示与平衡移动(解析版) 题型:选择题
使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)。下列说法错误的是
2NH3(g)(正反应为放热反应)。下列说法错误的是
A.升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变大
B.升高平衡体系的温度(保持体积不变),混合气体的密度不变
C.当反应达到平衡时,N2和H2的浓度比是1∶3
D.当达到平衡时,充入氩气,并保持压强不变,平衡将逆向移动
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习4(解析版) 题型:填空题
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)写出Ti基态原子的电子排布 。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C B(选填“>”“<”),第一电离能N>O,原因是 。
(3)月球岩石玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为 ,其中硫原子采用 杂化,氧原子的价电子排布图为 ,任意写出一种SO42-等电子体 。
(4)将TiOSO4的稀溶液加热水解后,经进一步反应,可得到钛的某种氧化物。该氧化物的晶胞结构图如图所示。
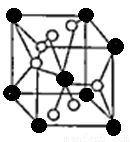
则该氧化物的化学式 (图中钛原子用“O”表示。氧原子用“O”表示)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学资源的综合应用(解析版) 题型:选择题
实验室从海带灰中提取碘的操作过程中,仪器选用不正确的是
A.称取3g左右的干海带——托盘天平
B.灼烧干海带至完全变成灰烬——蒸发皿
C.过滤煮沸后的海带灰和水的混合物——漏斗
D.用四氯化碳从氧化后的海带灰浸取液中提取碘——分液漏斗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com