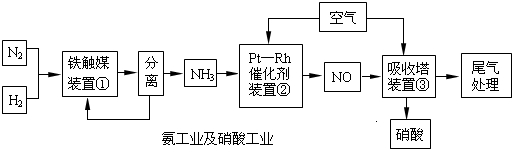
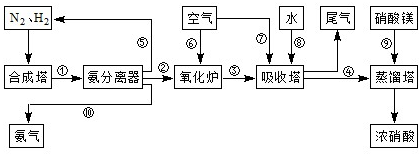
№ӨТөәПіЙ°ұУлЦЖұёПхЛбТ»°гҝЙБ¬РшЙъІъЈ¬БчіМИзПВЈә
ЈЁ1Ј©№ӨТөЙъІъКұЈ¬ЦЖИЎЗвЖшөДТ»ёц·ҙУҰОӘЈәCO+H
2OЈЁgЈ©?CO
2+H
2ўЩtЎжКұЈ¬Нщ1LГЬұХИЭЖчЦРідИл0.2mol COәН0.3molЛ®ХфЖшЈ®·ҙУҰҪЁБўЖҪәвәуЈ¬МеПөЦРcЈЁH
2Ј©=0.12mol?L
-1Ј®ёГОВ¶ИПВҙЛ·ҙУҰөДЖҪәвіЈКэK=
1
1
ЈЁМојЖЛгҪб№ыЈ©Ј®
ўЪұЈіЦОВ¶ИІ»ұдЈ¬ПтЙПКцЖҪәвМеПөЦРФЩјУИл0.1molCOЈ¬өұ·ҙУҰЦШРВҪЁБўЖҪәвКұЈ¬Л®ХфЖшөДЧӘ»ҜВКҰБЈЁH
2OЈ©=
50%
50%
Ј®
ЈЁ2Ј©әПіЙЛюЦР·ўЙъ·ҙУҰN
2ЈЁgЈ©+3H
2ЈЁgЈ©?2NH
3ЈЁgЈ©Ј»ЎчHЈј0Ј®ПВұнОӘІ»Н¬ОВ¶ИПВёГ·ҙУҰөДЖҪәвіЈКэЈ®УЙҙЛҝЙНЖЦӘЈ¬ұнЦР
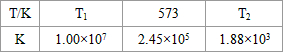
T
1Јј
Јј
573KЈЁМоЎ°ЈҫЎұЎўЎ°ЈјЎұ»тЎ°=ЎұЈ©Ј®
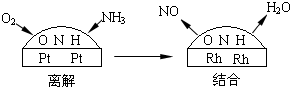
ЈЁ3Ј©NH
3әНO
2ФЪІ¬ПөҙЯ»ҜјБЧчУГПВҙУ145ЎжҫНҝӘКј·ҙУҰЈә4NH
3ЈЁgЈ©+5O
2ЈЁgЈ©?4NOЈЁgЈ©+6H
2OЈЁgЈ©ЎчH=-905kJ?mol
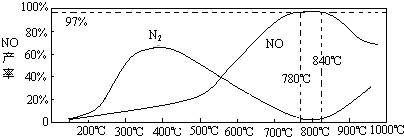
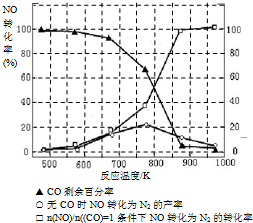
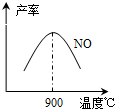
-1Ј¬І»Н¬ОВ¶ИПВNOІъВКИзУТНјЛщКҫЈ®ОВ¶ИёЯУЪ900ЎжКұЈ¬NOІъВКПВҪөөДФӯТт
ОВ¶ИёЯУЪ900ЎжКұЈ¬ЖҪәвПтЧуТЖ¶Ҝ
ОВ¶ИёЯУЪ900ЎжКұЈ¬ЖҪәвПтЧуТЖ¶Ҝ
Ј®
ЈЁ4Ј©·ПЛ®ЦРөДNЎўPФӘЛШКЗФміЙЛ®Меё»УӘСш»ҜөД№ШјьТтЛШЈ¬Е©Т©і§ЕЕ·ЕөД·ПЛ®ЦРіЈә¬УРҪП¶аөДNH
4+әНPO
43-Ј¬Т»°гҝЙТФНЁ№эБҪЦЦ·Ҫ·ЁҪ«ЖдіэИҘЈ®
ўЩ·Ҫ·ЁТ»ЈәҪ«CaЈЁOHЈ©
2»тCaO Н¶јУөҪҙэҙҰАнөД·ПЛ®ЦРЈ¬ЙъіЙБЧЛбёЖЈ¬ҙУ¶шҪшРР»ШКХЈ®өұҙҰАнәуөД·ПЛ®ЦРcЈЁCa
2+Ј©=2ЎБ10
-7 mol/LКұЈ¬ИЬТәЦРcЈЁPO
43-Ј©=
5ЎБ10-7
5ЎБ10-7
mol/LЈ®
ЈЁТСЦӘK
sp[Ca
3ЈЁPO
4Ј©
2]=2ЎБ10
-33Ј©
ўЪ·Ҫ·Ё¶юЈәФЪ·ПЛ®ЦРјУИлГҫҝу№ӨТө·ПЛ®Ј¬ҫНҝЙТФЙъіЙёЯЖ·О»өДБЧҝуКҜ-Дс·аКҜЈ¬·ҙУҰөД·ҪіМКҪОӘMg
2++NH
4++PO
43-=MgNH
4PO
4ЎэЈ®ёГ·Ҫ·ЁЦРРиТӘҝШЦЖОЫЛ®өДpHОӘ7.5Ў«10Ј¬ИфpHёЯУЪ10.7Ј¬Дс·аКҜөДІъБҝ»бҙуҙуҪөөНЈ®ЖдФӯТтҝЙДЬОӘ
өұpHёЯУЪ10.7КұЈ¬ИЬТәЦРөДMg2+ЎўNH4+»бУлOH-·ҙУҰЈ¬ЖҪәвПтДж·ҙУҰ·ҪПтТЖ¶Ҝ
өұpHёЯУЪ10.7КұЈ¬ИЬТәЦРөДMg2+ЎўNH4+»бУлOH-·ҙУҰЈ¬ЖҪәвПтДж·ҙУҰ·ҪПтТЖ¶Ҝ
Ј®Ул·Ҫ·ЁТ»ПаұИЈ¬·Ҫ·Ё¶юөДУЕөгОӘ
ДЬН¬КұіэИҘ·ПЛ®ЦРөДөӘЈ¬ід·ЦАыУГБЛГҫҝу№ӨТө·ПЛ®
ДЬН¬КұіэИҘ·ПЛ®ЦРөДөӘЈ¬ід·ЦАыУГБЛГҫҝу№ӨТө·ПЛ®
Ј®

 №ӨТөәПіЙ°ұУлЦЖұёПхЛбТ»°гҝЙБ¬РшЙъІъЈ¬БчіМИзПВЈә
№ӨТөәПіЙ°ұУлЦЖұёПхЛбТ»°гҝЙБ¬РшЙъІъЈ¬БчіМИзПВЈә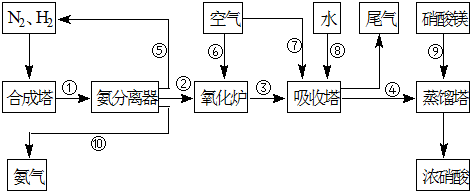
 ЈЁўЩ+ўЪЈ©өГөҪЈ¬ЛщТФ1molјЧНйЦұҪУҪ«NO2»№ФӯОӘN2өДИИ»ҜС§·ҪіМКҪОӘCH4ЈЁgЈ©+2NO2ЈЁgЈ©=CO2ЈЁgЈ©+N2ЈЁgЈ©ЎчH=+867kJ/molЈ¬№Кҙр°ёОӘЈәCH4ЈЁgЈ©+2NO2ЈЁgЈ©=CO2ЈЁgЈ©+N2ЈЁgЈ©ЎчH=+867kJ/molЈ®
ЈЁўЩ+ўЪЈ©өГөҪЈ¬ЛщТФ1molјЧНйЦұҪУҪ«NO2»№ФӯОӘN2өДИИ»ҜС§·ҪіМКҪОӘCH4ЈЁgЈ©+2NO2ЈЁgЈ©=CO2ЈЁgЈ©+N2ЈЁgЈ©ЎчH=+867kJ/molЈ¬№Кҙр°ёОӘЈәCH4ЈЁgЈ©+2NO2ЈЁgЈ©=CO2ЈЁgЈ©+N2ЈЁgЈ©ЎчH=+867kJ/molЈ®

 ГыРЈҝОМГПөБРҙр°ё
ГыРЈҝОМГПөБРҙр°ё


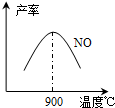
 ЈЁ3Ј©NH3әНO2ФЪІ¬ПөҙЯ»ҜјБЧчУГПВҙУ145ЎжҫНҝӘКј·ҙУҰЈә4NH3ЈЁgЈ©+5O2ЈЁgЈ©?4NOЈЁgЈ©+6H2OЈЁgЈ©ЎчH=-905kJ?mol-1Ј¬І»Н¬ОВ¶ИПВNOІъВКИзУТНјЛщКҫЈ®ОВ¶ИёЯУЪ900ЎжКұЈ¬NOІъВКПВҪөөДФӯТт
ЈЁ3Ј©NH3әНO2ФЪІ¬ПөҙЯ»ҜјБЧчУГПВҙУ145ЎжҫНҝӘКј·ҙУҰЈә4NH3ЈЁgЈ©+5O2ЈЁgЈ©?4NOЈЁgЈ©+6H2OЈЁgЈ©ЎчH=-905kJ?mol-1Ј¬І»Н¬ОВ¶ИПВNOІъВКИзУТНјЛщКҫЈ®ОВ¶ИёЯУЪ900ЎжКұЈ¬NOІъВКПВҪөөДФӯТт
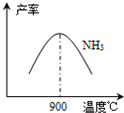 ЈЁ3Ј©N2әНH2ФЪМъЧчҙЯ»ҜјБЧчУГПВҙУ145ЎжҫНҝӘКј·ҙУҰЈ¬І»Н¬ОВ¶ИПВNH3ІъВКИзНјЛщКҫЈ®ОВ¶ИёЯУЪ900ЎжКұЈ¬NH3ІъВКПВҪөөДФӯТт
ЈЁ3Ј©N2әНH2ФЪМъЧчҙЯ»ҜјБЧчУГПВҙУ145ЎжҫНҝӘКј·ҙУҰЈ¬І»Н¬ОВ¶ИПВNH3ІъВКИзНјЛщКҫЈ®ОВ¶ИёЯУЪ900ЎжКұЈ¬NH3ІъВКПВҪөөДФӯТт