
分析 (1)乙烯含有碳碳不饱和键,能和溴发生加成反应;
(2)乙烯不饱和的C=C双键中其中1个C-C断裂结合水提供的-H、-OH,发生加成反应;
(3)乙炔分子中含有碳碳三键,能够与溴发生加成反应;
(4)乙炔与氯化氢加成生成氯乙烯.
解答 解:(1)含有不饱和键的有机分子能发生加成反应,有机物分子中的不饱和键断裂,断键原子与其它原子或原子团相结合,生成新的化合物,乙烯含有碳碳双键,能和溴反应生成1,2-二溴乙烷,化学方程式为Br2+CH2=CH2→BrCH2CH2Br,
故答案为:CH2=CH2+Br2→CH2BrCH2Br;
(2)CH2=CH2中不饱和的C=C双键中其中1个C-C断裂结合水提供的-H、-OH,生成乙醇,方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;
(3)乙炔含有碳碳三键,能和溴反应生成1,1,2,2-四溴乙烷,化学方程式为Br2+CH≡CH→Br2CHCHBr2,
故答案为:Br2+CH≡CH→Br2CHCHBr2;
(4)乙炔与氯化氢加成反应的方程式:CH≡CH+HCl→CH2=CHCl,
故答案为:CH≡CH+HCl→CH2=CHCl.
点评 本题考查有机物乙烯、乙炔的化学性质以及方程式的书写,掌握乙烯、乙炔的官能团碳碳双键、碳碳三键的性质是书写化学方程式的关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
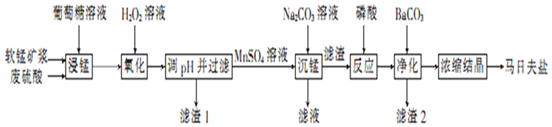
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.8 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
| Mn2+ | 7.8 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成0.1NA根共价键 | B. | 消耗反应物总体积2.24L | ||
| C. | 转移了2NA个电子 | D. | 产物溶于水后,溶液pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
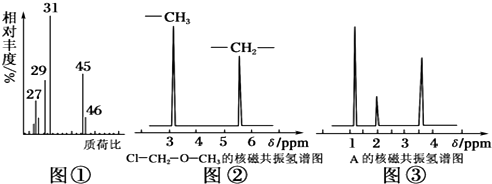
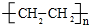 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
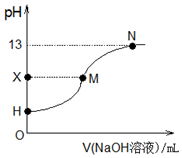
| A. | 酸碱滴定选用指示剂:甲基橙试液 | |
| B. | H点处的溶液:pH<3 | |
| C. | X=7时,M点对应加入氢氧化钠溶液的体积:25.00 mL | |
| D. | H、M、N三点各自对应的溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com