
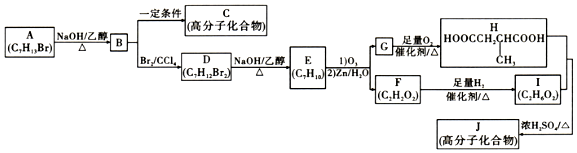
 在25℃时,将 1.0L wmoI/L CH3COOH 溶液与 0.1mol NaOH固体混合,充分反应.然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示. 下列叙述正确的是( )
在25℃时,将 1.0L wmoI/L CH3COOH 溶液与 0.1mol NaOH固体混合,充分反应.然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示. 下列叙述正确的是( )| A. | a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b | |
| B. | b点混合液中 c(Na+)>c(CH3COO-) | |
| C. | 加入CH3COOH过程中,$\frac{c(N{a}^{+})•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$增大 | |
| D. | 25℃时,CH3COOH的电离平衡常数Ka=$\frac{0.2×1{0}^{-7}}{w-0.1}$mol/L |
分析 1.0L w mol•L-1 CH3COOH溶液与0.1mol NaOH固体混合,混合后溶液的pH<5,显酸性,说明醋酸过量,溶液中溶质为CH3COOH和CH3COONa;加醋酸时,酸的量增多,使溶液酸性增强;加CH3COONa时,CH3COONa本身水解显碱性,相当于加碱,使溶液酸性减弱,最终达到中性;
A.溶液中酸或碱电离的氢离子或氢氧根离子的浓度越大,水的电离程度越小;
B.b点溶液pH<5,溶液显酸性,溶液中c(H+)>c(OH-),根据电荷守恒分析;
C.醋酸存在电离平衡,其平衡常数表达式为${K}_{a}=\frac{c({H}^{+})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$,溶液中${K}_{w}=c({H}^{+})c(O{H}^{-})$,据此分析;
D.pH=7时,溶液中c(H+)=c(OH-),醋酸的电离平衡常数为${K}_{a}=\frac{c({H}^{+})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$,根据电荷守恒分析计算.
解答 解:1.0L w mol•L-1 CH3COOH溶液与0.1mol NaOH固体混合,混合后溶液的pH<5,显酸性,说明醋酸过量,溶液中溶质为CH3COOH和CH3COONa;加醋酸时,酸的量增多,使溶液酸性增强;加CH3COONa时,CH3COONa本身水解显碱性,相当于加碱,使溶液酸性减弱,最终达到中性;
A.溶液中酸或碱电离的氢离子或氢氧根离子的浓度越大,水的电离程度越小,a、b、c三点溶液中氢离子浓度依次减小,水的电离程度增大,所以水的电离程度由大到小的顺序的是c>b>a,故A错误;
B.b点溶液pH<5,溶液显酸性,溶液中c(H+)>c(OH-),溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于c(H+)>c(OH-),所以c(Na+)<c(CH3COO-),故B错误;
C.向混合液中加入CH3COOH固体,忽略溶液体积的变化,则溶液中c(Na+)不变,溶液中$\frac{c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{{K}_{w}}{{K}_{a}c(C{H}_{3}COOH)}$,因此溶液中$\frac{c(N{a}^{+})c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{c(N{a}^{+}){K}_{w}}{{K}_{a}c(C{H}_{3}COOH)}$,随着CH3COOH固体的不断加入,溶液中c(CH3COOH)不断增大,则该值减小,故C错误;
D.pH=7时,溶液中c(H+)=c(OH-),溶液中存在电荷守恒,则c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于c(H+)=c(OH-),则此时溶液中c(Na+)=c(CH3COO-),根据图象,c(H+)=10-7mol•L-1,c(Na+)=c(CH3COO-)=0.2mol/L,则醋酸的电离平衡常数为${K}_{a}=\frac{c({H}^{+})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{0.2×1{0}^{-7}}{w-0.1}mol/L$,故D正确;故选D.
点评 本题主要考察弱电解质的电离平衡,盐类水解,溶液pH的判断,平衡常数的计算等知识,结合图象分析是解题的关键,需要牢牢把握守恒思想.本题难度中等.


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:解答题
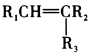 $→_{(2)Zn/H_{2}O}^{(1)O_{3}}$
$→_{(2)Zn/H_{2}O}^{(1)O_{3}}$
 .
. +(2n-1)H2O.
+(2n-1)H2O. .
. →
→ 的流程.(无机试剂及溶剂任选)
的流程.(无机试剂及溶剂任选)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④ | C. | ②③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42gC3H6中含有的共用电子对数目为 8NA | |
| B. | 由 6gCaCO3和 5gKHCO3组成的混合物中含有的碳原子数为 0.11NA | |
| C. | 标准状况下,22.4L 氯气和 56g 铁充分反应,转移的电子数为 3NA | |
| D. | 1L0.01mol•L-1KAl(SO4)2溶液中含有的阳离子数为 0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消除硫酸厂尾气排放 SO2+NH3+H2O═(NH4)2SO3 | |
| B. | 消除制硝酸工业尾气的氮氧化物污染 NO2+NO+NaOH═2NaNO2+H2O | |
| C. | 制CuSO4Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O | |
| D. | 制CuSO4 2Cu+O2═2CuO,CuO+H2SO4(稀)═CuSO4+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L甲烷中含有的氢原子数为2NA | |
| B. | 标准状况下,0.3 mol二氧化硫中含有的氧原子数为0.3NA | |
| C. | 常温下,2.7 g Al与足量的盐酸反应,生成H2的分子数为0.15NA | |
| D. | 常温下,0.1 mol•L-1MgCl2溶液中含Cl-数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、D、T互为同素异形体 | B. | 质量数为31的磷原子:${\;}_{15}^{31}$P | ||
| C. | 次氯酸的电子式: | D. | 乙烯的结构简式是:CH2CH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com