
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.5 |
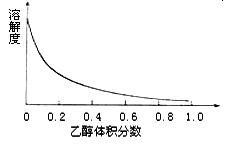
| A.无水乙醇 | B.蒸馏水 |
| C.95%乙醇溶液 | D.饱和硫酸钠溶液 |
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
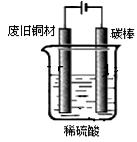
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源:不详 题型:实验题
 l2+2H2SO4
l2+2H2SO4 2CaSO4+2Cl2↑+2H2O他们设计了如图所示装置制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O他们设计了如图所示装置制取氯气并验证其性质的实验。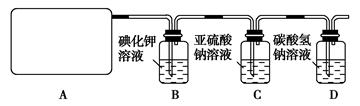
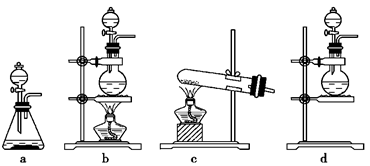
 ________________ 。
________________ 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用启普发生器制取,用排水法收集 |
| B.用启普发生器制取,用向下排空气法收集 |
| C.与加热分解KClO3制氧气的装置相同,用向下排空气法收集 |
| D.与加热分解KClO3制氧气的装置相同,用向上排空气法收集 |
查看答案和解析>>
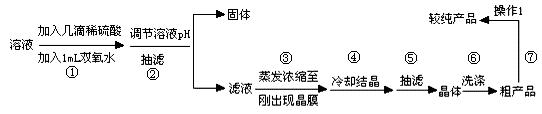
科目:高中化学 来源:不详 题型:实验题
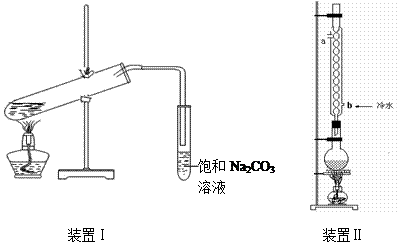
| 物 质 |
| 沸点/℃ | 密度/g·cm-3 | ||
| 乙 醇 | -114 | 78 | 0.789 | ||
| 乙 酸 | 16.6 | 117.9 | 1.05 | ||
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 | ||
| 98%H2SO4 | 10 | 338 | 1.84 |
 从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入 (填仪器名称),用力振
从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入 (填仪器名称),用力振 荡,静置, (填现象),然后将产物从_____口(填“上”或“下”)倒出。
荡,静置, (填现象),然后将产物从_____口(填“上”或“下”)倒出。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
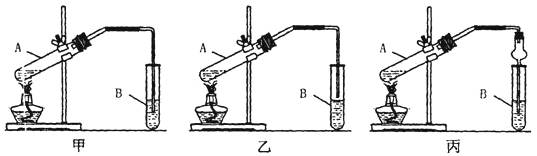
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
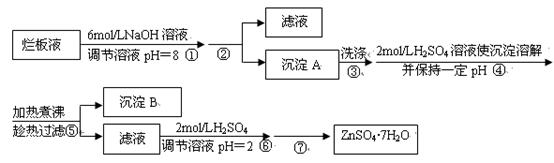
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Zn2+ | 6.4 | 8.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
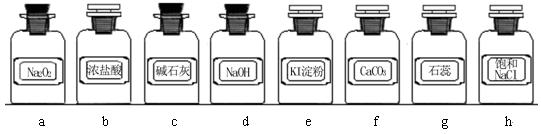
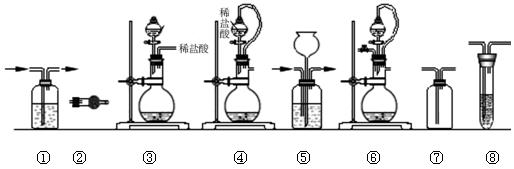
| 组合 | 制备装置 | 净化装置 | 检验装置/试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③、⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ④、⑥ | ⑤ | ⑧/g | ① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
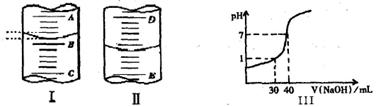
 液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)_
液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)_ _________。
_________。
 滴定后气泡消失
滴定后气泡消失查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
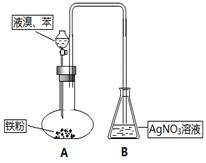
| A.装有NaOH溶液的洗气瓶 | B.装有CC14的洗气瓶 |
| C.装有KI溶液的洗气瓶 | D.装有湿润淀粉KI试纸的集气瓶 |
 以上步骤中:验证沉淀已洗涤干净的方法是_______________________________________。
以上步骤中:验证沉淀已洗涤干净的方法是_______________________________________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com