
 ;
; ;
;

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
 )可用于制造多种高分子材料.现有如下转化关系.
)可用于制造多种高分子材料.现有如下转化关系.

 可以得到制取双酚A的原料,该有机物含苯环的同分异构体还有
可以得到制取双酚A的原料,该有机物含苯环的同分异构体还有查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 两种有机物A、B的分子式均为C11H12O5,均能发生如图变化.
两种有机物A、B的分子式均为C11H12O5,均能发生如图变化.查看答案和解析>>
科目:高中化学 来源: 题型:
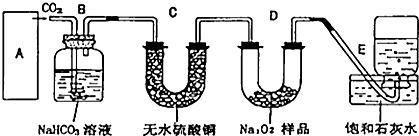

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液加AgNO3溶液生成白色沉淀,说明原溶液中有Cl- |
| B、某溶液加BaCl2溶液生成白色沉淀,说明原溶液中有SO42- |
| C、某溶液加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+ |
| D、某溶液加KOH溶液生成红褐色沉淀,说明原溶液中有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
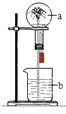 在如图所示的装置中,烧瓶中充满干燥的气体a,将滴管内的液体b挤入烧瓶内,轻轻振荡烧瓶,并打开弹簧夹,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别可能是( )
在如图所示的装置中,烧瓶中充满干燥的气体a,将滴管内的液体b挤入烧瓶内,轻轻振荡烧瓶,并打开弹簧夹,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别可能是( )| A、NO2和水 |
| B、SO2和NaOH溶液 |
| C、NH3和稀盐酸 |
| D、Cl2和饱和NaCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com