
【题目】中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用。若1 mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )

A.2mol Br2、3mol NaOH B.3mol Br2、3mol NaOH
C.3mol Br2、4mol NaOHD.4mol Br2、4mol NaOH
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为测定CuSO4溶液的浓度,甲、乙两同学设计了两个方案。回答下列问题:
Ⅰ.甲方案
实验原理:![]()
实验步骤:

(1)判断![]() 沉淀完全的操作为____________。
沉淀完全的操作为____________。
(2)步骤②判断沉淀是否洗净所选用的试剂为_____________。
(3)步骤③灼烧时盛装样品的仪器名称为__________。
(4)固体质量为wg,则c(CuSO4)=________molL-1。
(5)若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4)_________(填“偏高”、“偏低”或“无影响”)。
Ⅱ.乙方案
实验原理:![]() ,
,![]()

实验步骤:
①按右图安装装置(夹持仪器略去)
②……
③在仪器A、B、C、D、E…中加入图示的试剂
④调整D、E中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录。
⑤将CuSO4溶液滴入A中搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生
⑥待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录
⑦处理数据
(6)步骤②为___________。
(7)步骤⑥需保证体系恢复到室温的原因是________(填序号)。
a.反应热受温度影响 b.气体密度受温度影响 c.反应速率受温度影响
(8)Zn粉质量为ag,若测得H2体积为bmL,已知实验条件下![]() ,则c(CuSO4)______molL-1(列出计算表达式)。
,则c(CuSO4)______molL-1(列出计算表达式)。
(9)若步骤⑥E管液面高于D管,未调液面即读数,则测得c(CuSO4)________(填“偏高”、“偏低”或“无影响”)。
(10)是否能用同样的装置和方法测定MgSO4溶液的浓度:_________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气(Cl2)是高中化学一种非常重要的气体单质,它是制备许多化工产品的原料。
Ⅰ.甲同学在实验室用体积比为1:3的氯气和空气(不参与反应)的混合气体与潮湿的碳酸钠反应来制备Cl2O,其实验装置如图所示。

已知:Cl2O熔点为-120.6℃,沸点为2.0℃,常温常压下为一种棕黄色气体。
(1)仪器B的名称为________,KMnO4与浓盐酸反应生成Cl2的离子方程式为________。
(2)装置C的作用为________,装置E中的现象是________。
(3)氯气与潮湿的碳酸钠制Cl2O的化学方程式为________。
Ⅱ.乙同学在实验室用Cl2和熔融的S反应制备S2Cl2,其实验装置如图所示。

已知:S2Cl2熔点为-76℃,沸点为138℃,常温下为橙黄色的液体,遇水易水解。
(4)W中盛放的试剂为________。
(5)乙同学应进行合理的操作顺序为________(填序号)。
a.点燃酒精灯 b.停止通氯气 c.开始通氯气 d.熄灭酒精灯
(6)检验S2Cl2和水反应的产生的气体为SO2的实验操作为________。
(7)本实验需改进的地方为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的容积不变的密闭容器中,下列叙述不是可逆反应A(g)+3B(g)![]() 2C(g)+2D(s)达到平衡的标志的是
2C(g)+2D(s)达到平衡的标志的是
① C的生成速率与C的消耗速率相等 ②单位时间内生成amolA,同时生成3amolB
③ A、B、C的浓度不再改变 ④混合气体的密度不再改变
⑤ 混合气体的总压强不再改变 ⑥混合气体的总物质的量不再改变
⑦ A、B、C、D浓度之比为1:3:2:2
A. ②⑦ B. ②⑤⑦ C. ①③④⑦ D. ②⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气明朝《天工开物》中有世界上最早的“火法”炼锌技术的记载,锌是生命体必需的微量元素,被称为“生命之花”。(已知阿伏加德罗常数的值为NA)
(1)基态![]() 原子核外的最高能层符号是________,基态
原子核外的最高能层符号是________,基态![]() 最外层电子排布式为________。
最外层电子排布式为________。
(2)乳酸锌[ ]是一种很好的食品锌强化剂,其中存在的作用力有________(填编号)。
]是一种很好的食品锌强化剂,其中存在的作用力有________(填编号)。![]() 乳酸锌中含有________个σ键。
乳酸锌中含有________个σ键。
A.离子键 B.极性共价键 C.金属键 D.配位键 E.范德华力
(3)一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示。其中所涉及的非金属元素的电负性由大到小的顺序是________,![]() 分子的空间构型为________形,
分子的空间构型为________形,![]() 的配位数为________。甘氨酸(
的配位数为________。甘氨酸(![]() )中N原子的杂化轨道类型为________;甘氨酸易溶于水,试从结构角度解释________。
)中N原子的杂化轨道类型为________;甘氨酸易溶于水,试从结构角度解释________。
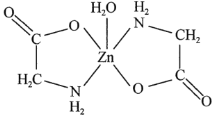
(4)Zn与S形成某种化合物的晶胞如图所示。

![]()
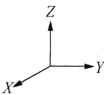
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图中原子1的坐标为![]() ,则原子2的坐标为________。
,则原子2的坐标为________。
②已知晶体密度为![]() ,
,![]() 半径为
半径为![]() ,若要使
,若要使![]() 、
、![]() 相切,则
相切,则![]() 半径为________
半径为________![]() (写计算表达式)。
(写计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种化合物如下:
甲: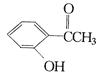 乙:
乙: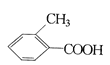 丙:
丙: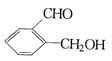
请分别写出鉴别甲、乙、丙三种化合物的方法(指明所选试剂及主要现象)鉴别甲的方法:__________鉴别乙的方法:_____________ ;鉴别丙的方法_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】-钒和五氧化二钒在工业中应用广泛,某工厂从钒渣(主要成分有 V2O3、FeO,还含有少量 CuO、Al2O3 等)中回收金属,工艺流程如图:
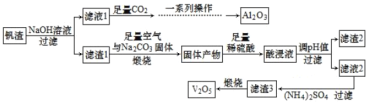
已知:①KspCu(OH)2=1.0×10-21,KspFe(OH)3=4.0×10-38 ,KspFe(OH)2=8.0×10-16
②NH4VO3 难溶于水,(VO2)2SO4 易溶于水。
(1)制取纯净的 Al2O3 需要经过“一系列操作”为过滤、___、___。
(2)滤渣 1 在“煅烧”过程中,主要成分 V2O3 转化为可溶性 NaVO3,写出其反应的化学方程式______ 。
(3)加入稀硫酸后,酸浸液中 VO![]() 与 VO
与 VO![]() 能大量共存的原因是______ (用离子方程式解释)。
能大量共存的原因是______ (用离子方程式解释)。
(4)常温下调节酸浸液的 pH=___,即可以完全除去铁、铜两种元素对应的离子; 实际 pH 值要调整到 8,其目的是______。
(5)请写出煅烧滤渣 3 时,发生反应的化学方程式 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】耐光高效的拟除虫菊酯相继开发成功,其中一个重要的产品灭杀菊酯的结构如下图。下列说法正确的是

A.该有机物分子式为C25H21O3NCl
B.该有机物中含有3个手性碳原子
C.该有机物中的碳原子杂化方式为 sp2 或 sp3
D.该有机物可以发生水解反应、加成反应、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验表明:将氯水滴加到蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是
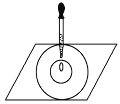
A. 此实验表明氯水具有酸性、漂白性
B. 内环呈白色外环呈红色或浅红色
C. 氯水中形成次氯酸的反应中还原产物是 HClO
D. 内外环上颜色的差异表明此变化过程中,中和反应比氧化还原反应快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com