
| A. | 1molO2与H2的混合气体中含有的分子数为NA | |
| B. | 1.7g NH3所含原子数为0.1NA | |
| C. | 通常状况下,11.2L N2中含有的原子数目为NA | |
| D. | 标准状况下,22.4L H2O中含有的氧原子数为NA |
分析 A、根据分子数N=nNA来计算;
B、求出氨气的物质的量,然后根据1mol氨气中含4mol原子来分析;
C、通常状况下,气体摩尔体积大于22.4L/mol;
D、标况下,水为液体.
解答 解:A、分子数N=nNA=1mol×NA/mol=NA个,故A正确;
B、1.7g氨气的物质的量n=$\frac{1.7g}{17g/mol}$=0.1mol,而1mol氨气中含4mol原子,故0.1mol氨气中含0.4mol原子即0.4NA个,故B错误;
C、通常状况下,气体摩尔体积大于22.4L/mol,故11.2L氨气的物质的量小于0.5mol,则含有的原子数小于NA个,故C错误;
D、标况下,水为液体,不能根据气体摩尔体积来计算其物质的量,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
 →Al(OH)3.
→Al(OH)3.| A. | 甲、乙消耗的原料同样多 | B. | 乙消耗的原料最少 | ||
| C. | 丙消耗的原料最少 | D. | 三者消耗的原料同样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示晶体中每个阳离子A或阴离子B,均可被另一种离子以四面体形式包围着,则该晶体对应的化学式为( )
如图所示晶体中每个阳离子A或阴离子B,均可被另一种离子以四面体形式包围着,则该晶体对应的化学式为( )| A. | AB | B. | A2B | C. | AB3 | D. | A2B3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
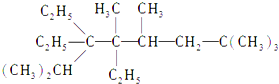 2,2,4,5,7,7-六甲基-3,3,4-乙基辛烷,
2,2,4,5,7,7-六甲基-3,3,4-乙基辛烷,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)=c(Na+)=c(OH-)>c(NH3•H2O) | B. | c(NH4+))=c(Na+)>c(NH3•H2O)>c(OH-) | ||
| C. | c(NH4+))>c(Na+)>c(OH-)>c(NH3•H2O) | D. | c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ③① | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸的水溶液呈酸性;则有酸性的水溶液也一定是酸的水溶液 | |
| B. | Fe3O4可写成FeO?Fe2O3;Pb3O4也可写成PbO?Pb2O3 | |
| C. | 可电解熔融MgCl2来制取金属镁;也能电解熔融HCl来制取氢气 | |
| D. | 第2周期元素氢化物稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物稳定性顺序是HCl>H2S>PH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com