
| A. | 40.625 | B. | 42.15 | C. | 38.225 | D. | 42.625 |
分析 2NH3+H2SO4=(NH4)2SO4(若氨气过量,则过量的氨气会溶于水);NO2和O2在溶液中发生如下反应:3NO2+H2O=2HNO3+NO、2NO+O2=2NO2,将两个反应方程式相加可得总反应方程式:O2+4NO2+2H2O=4HNO3,混合气体的物质的量为$\frac{26.88L}{22.4L/mol}$=1.2mol,带火星的木条插入剩余气体中,木条不复燃,可知剩余气体只有NO,其物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,结合反应计算.
解答 解:2NH3+H2SO4=(NH4)2SO4(若氨气过量,则过量的氨气会溶于水);NO2和O2在溶液中发生如下反应:3NO2+H2O=2HNO3+NO、2NO+O2=2NO2,将两个反应方程式相加可得总反应方程式:O2+4NO2+2H2O=4HNO3,混合气体的物质的量为$\frac{26.88L}{22.4L/mol}$=1.2mol,带火星的木条插入剩余气体中,木条不复燃,可知剩余气体只有NO,其物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,
由质量守恒定律可得:溶液增加的质量为溶解的气体的质量,所以溶液增加的质量加剩余气体的质量为原混合气体的质量,带火星的木头不复燃说明氧气充分反应,则剩余的2.24L气体为NO,剩余的NO的质量为m=n×M=0.1mol×30g/mol=3g,所以原混合气体的质量为3g+45.75g=48.75g,所以原混合气体的平均摩尔质量M=$\frac{48.75g}{1.2mol}$=40.625g/mol.
即原混合气体的平均相对分子质量为40.625(摩尔质量在数值上等于相对分子质量),
故选A.
点评 本题考查化学反应方程式的计算,为高频考点,把握质量守恒判断混合气体的质量为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺 | |
| B. | 四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成 | |
| C. | 工业上电解熔融状态的Al2O3制备Al | |
| D. | 为预防碘缺乏病,在食盐中加入碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
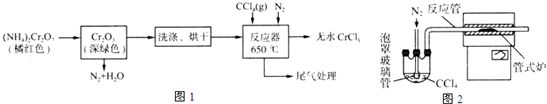
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 属于同种元素 | B. | 属于同位素 | C. | 属于同种核素 | D. | 属于同种原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
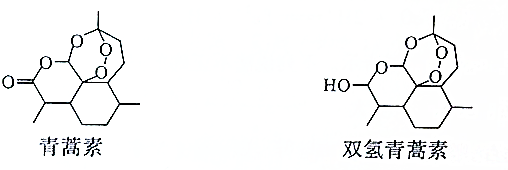
| A. | 双氢青篙素属于脂类物质 | |
| B. | 青蒿素的分子式为C15H21O5 | |
| C. | 青蒿素环上的一氯取代物有11种 | |
| D. | 青蒿素通过加成反应可以转化为双氢青蒿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇制乙醛、乙酸制乙酸乙酯均为取代反应 | |
| B. | 乙烯制聚乙烯、苯制硝基苯均发生加聚反应 | |
| C. | 蛋白质盐析、糖类水解均为化学变化 | |
| D. | 石油分馏、煤干馏均可得到烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COO-(aq)+H+(aq)△H=+0.3 kJ/mol.
CH3COO-(aq)+H+(aq)△H=+0.3 kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯化铝溶液中加入过量氨水:氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 氨气通入醋酸溶液中:NH3+CH3COOH═CH3COO+NH4+ | |
| C. | 氯化铁溶液中加入铁粉:Fe+2FeCl3═2Fe+3Cl- | |
| D. | 碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+Mg(OH)2↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com