
【题目】“探险队员”﹣﹣盐酸,不小心走进了化学迷宫,迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过. 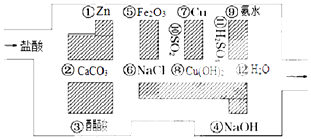
(1)请你帮助它走出迷宫(用图中物质前的序号连接起来表示所走的路线) .
(2)在能“吃掉”盐酸的化学反应中,写出属于酸和碱中和反应的方程式:
(3)在不能与盐酸反应的物质中,属于非电解质的是(填写物质序号).
(4)写出物质②的电离方程式
(5)写出盐酸与碳酸钙反应的离子方程式:
(6)写出Ag++Cl﹣=AgCl↓对应的化学方程式:
【答案】
(1)③→⑥→⑩→⑦→?→?
(2)HCl+NaOH=NaCl+H2O、2HCl+Cu(OH)2=Cu(OH)2+2H2O、HCl+NH3?H2O=NH4Cl+H2O
(3)⑩
(4)CaCO3=Ca2++CO32﹣
(5)2H++CaCO3=Ca2++CO2↑+H2O
(6)AgNO3+NaCl=AgCl↓+NaNO3
【解析】解:(1)利用图示的物质对相关的与盐酸不能反应的物质作出判断即可,由于盐酸不能和③醋酸、⑥NaCl、⑩SO2、⑦Cu、H2SO4、H2O反应,故路线为③→⑥→⑩→⑦→→,
所以答案是:③→⑥→⑩→⑦→→;(2)在能和盐酸反应的物质中,NaOH、Cu(OH)2和氨水为碱,化学方程式分别为:HCl+NaOH=NaCl+H2O、2HCl+Cu(OH)2=Cu(OH)2+2H2O、HCl+NH3H2O=NH4Cl+H2O,
所以答案是:HCl+NaOH=NaCl+H2O、2HCl+Cu(OH)2=Cu(OH)2+2H2O、HCl+NH3H2O=NH4Cl+H2O;(3)在水溶液中和熔融状态下均不能导电的化合物为非电解质,包括蔗糖、酒精、非金属氧化物和氨气等,故属于非电解质的是SO2 , 所以答案是:⑩;(4)CaCO3是强电解质,能完全电离为钙离子和碳酸根,故用等号,电离方程式为:CaCO3=Ca2++CO32﹣ , 所以答案是:CaCO3=Ca2++CO32﹣;(5)CaCO3是弱酸盐,能和盐酸发生复分解反应生成氯化钙和、二氧化碳,故离子方程式为:2H++CaCO3=Ca2++CO2↑+H2O,所以答案是:2H++CaCO3=Ca2++CO2↑+H2O;(6)一个化学方程式能拆出的Ag++Cl﹣=AgCl↓形式,说明是可溶性银盐和盐酸或可溶性盐酸盐反应,生成氯化银和一种强酸或可溶性盐,故对应的化学方程式可以为:AgNO3+NaCl=AgCl↓+NaNO3 , 所以答案是:AgNO3+NaCl=AgCl↓+NaNO3 .


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化学概念在逻辑上存在如图关系,对下列概念的说法正确的是( ) 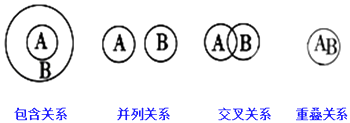
A.化合物与氧化物属于交叉关系
B.单质与非电解质属于包含关系
C.溶液与分散系属于并列关系
D.化合物与电解质属于包含关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1![]() 二元弱酸
二元弱酸![]() 溶液的pH,溶液中的
溶液的pH,溶液中的![]() 、
、![]() 、
、![]() 的物质的量分数
的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是( )
A. pH=1.2时, ![]()
B. ![]()
C. pH=2.7时, ![]()
D. pH=4.2时, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 溴在海水中以化合态形式存在
B. 从海水中提取溴要经历浓缩、氧化和提取三个步骤
C. 提取金属镁是电解氯化镁的熔融液
D. 溴在常温下是液态,其颜色与氯气颜色相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量含Cu、Cu2O、CuO的固体混合物,将其分成两等份并进行下列转化, 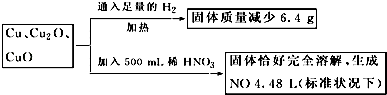
则转化过程中所加稀HNO3的物质的量浓度为( )
A.4.4 molL﹣1
B.3.6 molL﹣1
C.4.0 molL﹣1
D.3.2 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A.HClO的结构式:H﹣Cl﹣O
B.Na2O2的电子式: ![]()
C.中子数为20的氯原子: ![]() Cl
Cl
D.铝原子的结构示意图 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气主要的危害是形成光化学烟雾,危害人类健康.HNCO可用于消除汽车尾气中的NO和NO2 , 其反应原理为:HNCO+NOx→N2+CO2+H2O,下列说法正确的是( )
A.CO2分子中既含有极性键又含有非极性键
B.4.3g HNCO中含有0.1NA个原子
C.反应中NOx是还原剂
D.若NOx中x=2,1mol NO2在反应中转移4NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中,不正确的是( )
A. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
B. 明矾水解的离子方程式: Al3++ 3 H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
C. 以石墨作电极电解氯化铝溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D. 硫化氢在水溶液中的电离方程式:H2S + H2O![]() HS- + H3O+
HS- + H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积为0.1L的密闭容器中,通入0.4molN2和1.2molH2,进行反应,2s后达到平衡,此时容器内的压强为起始时的3/4,试回答:
(1)能判断该反应达到平衡状态的依据是___________
A.断开3molH—H键的同时断开2molN—H键 B.c(N2) : c(H2): c(NH3) =1:3:2
C.混合气体的平均相对分子质量不变 D.容器内密度不变
(2)N2的转化率α1%=_________,若相同条件下,此反应在容积可变的容器中进行,保持压强不变,达到平衡,则N2的转化率α2%________α1%(填“>”、“<”或“=”)
(3)该温度下,反应的化学平衡常数K=__________,若此时再加入0.6molN2和0.4mol NH3,则平衡_______________(填“向左移动”、“向右移动”或“不移动”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com