
| A. | 标准状况下,22.4 L二氯甲烷的分子数约为NA | |
| B. | 室温下,1L pH=12的碳酸钠溶液中含有Na+的数目为0.02NA | |
| C. | 1L 0.1mol•L-1K2Cr2O7溶液中Cr2O72-的数目小于0.1NA | |
| D. | 电解精炼铜时,若阴极得到的电子数为2NA,则阳极质量一定减少64 g |
分析 A.气体摩尔体积使用对象为气体;
B.碳酸钠溶液中碳酸根离子部分水解生成氢氧根离子,钠离子的物质的量大于碳酸根离子的2倍;
C.重铬酸根离子能与水反应生成铬酸根离子;
D.电解精炼铜时,阳极上是粗铜,粗铜上有其他金属杂质.
解答 解:A.二氯甲烷标况下为液体,不能使用气体摩尔体积,故A错误;
B.25℃时,1L pH=12的Na2CO3溶液中含有0.01mol氢氧根离子,碳酸根离子在溶液中部分水解生成氢氧根离子,所以碳酸根离子的物质的量大于0.01mol,钠离子的物质的量大于0.02mol,溶液中含有Na+的数目大于0.02NA,故B错误;
C.重铬酸根离子能与水反应生成铬酸根离子,所以1L 0.1mol•L-1K2Cr2O7溶液中Cr2O72-的数目小于0.1NA,故C正确;
D.电解精炼铜时,阳极上是粗铜,粗铜上有其他比铜活泼的金属杂质也会放电,故阴极得到电子数为2NA时,阳极减少的质量不一定是64g,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积的使用对象和条件.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molNO和CO2的混合气体所含的原子数目为2NA | |
| B. | 在常温常压下,32g氧气所含的原子数目为NA | |
| C. | 在常温常压下,11.2L氮气所含的分子数目为0.5NA | |
| D. | 17g氨气所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子直径与分散系种类: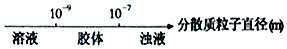 | |
| B. | NaOH溶液与CO2反应后溶液中的钠盐: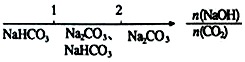 | |
| C. | AlCl3溶液中滴加NaOH溶液后铝的存在形式: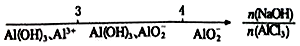 | |
| D. | Na与O2反应的产物: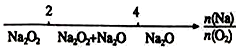 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲-②,乙-④ | B. | 乙-③,丙-③ | C. | 乙-④,丁-② | D. | 丙-①,丁-② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述生成Ni(CO)4(g)的反应为吸热反应 | |
| B. | 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 | |
| C. | 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v正<v逆 | |
| D. | 恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com