
【题目】气态可逆反应:mA(g)+nB(g)![]() pC(g)+qD(g),有如图关系,试用“>”或“<”填(1)~(3)题。
pC(g)+qD(g),有如图关系,试用“>”或“<”填(1)~(3)题。

(1)温度T1 _________T2 。
(2)压强p1 _________p2 。
(3)m+n_________p+q。
(4)正反应为_____反应(填“放热”或“吸热”)。
科目:高中化学 来源: 题型:
【题目】(前两空每空2分,后三空每空3分,共13分)氮气与氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
(1)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___(填“大于”“等于”或“小于”)92 kJ,原因 是______________;若加入催化剂,ΔH___(填“变大”“变小”或“不变”)。
(2)已知:破坏1 mol N≡N键、1 mol H—H键需要吸收的能量分别为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为_____kJ。
(3)N2H4可视为NH3分子中的一个H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂,生成N2和H2O(g)。
已知:N2(g)+2O2(g)![]() 2NO2(g) ΔH1=+67.7 kJ·mol-1
2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)![]() N2(g)+2H2O(g)ΔH2=-534 kJ·mol-1。
N2(g)+2H2O(g)ΔH2=-534 kJ·mol-1。
则:1 mol N2H4与NO2完全反应的热化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有用饱和Na2SO4溶液浸泡过的琼脂。下列说法正确的是

A.b电极上发生的反应:Fe2+ - e- ═ Fe3+
B.a电极上发生氧化反应:MnO4- + 8H+ + 5e- ═ Mn2+ + 4H2O
C.外电路电子的流向是从a到b
D.电池工作时,盐桥中的SO42-移向甲烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将三种黑色粉末组成的混和物加入到足量的某热浓酸中,充分反应后得到蓝绿色溶液和两种气体。将从蓝绿色溶液中分离得到的盐与0.15mol还原铁粉恰好反应完全,可得浅绿色溶液和6.4g红色沉淀;将上述生成的两种气体通入足量饱和NaHCO3溶液中,仍然收集到两种气体,据此推断黑色粉末可能为
A.物质的量 FeS:CuO:Fe =1:1:1 B.物质的量 C:CuO:Fe=3:2:2
C.质量 MnO2:CuO:C=5.5:8:12 D.质量 Fe:C:CuO=7:5:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】装置(Ⅰ)为铁镍(Fe-Ni)可充电电池:Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是
Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是

A. 闭合K时,X的电极反应式为:2H++2e-= H2↑
B. 闭合K时,A电极反应式为:NiO2+2e-+2H+= Ni(OH)2
C. 给装置(Ⅰ)充电时,B极参与反应的物质被氧化
D. 给装置(Ⅰ)充电时,OH- 通过阴离子交换膜,移向A电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,电解质溶液中的下列关系式不正确的是
A.已知A+H2B(过量)![]() HA+HB,则结合H+的能力:HB<A<B2
HA+HB,则结合H+的能力:HB<A<B2
B.在0.1 molL1的氨水中滴加0.1 molL1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH)=10a molL1
C.将c molL1的醋酸溶液与0.02 molL1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=![]()
D.将0.2 mol·L1盐酸与0.1 mol·L1的KAlO2溶液等体积混合,溶液中离子浓度由小到大的顺序:
c(Cl)>c(K+)>c(Al3+)>c(H+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:
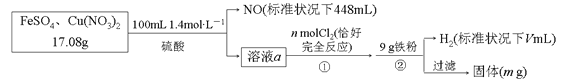
下列叙述中不正确的是
A.n=0.02 B.V=2240
C.m=3.2 D.原混合物中FeSO4的质量分数约为89%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是 (填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):

回答下列问题:
①在步骤i中产生的有毒气体可能有_____________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×1032,此时理论上将Al3+沉淀完全,则溶液的pH为______。
③步骤iv中,生成FeCO3的离子方程式是_______________________________。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式 。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释 。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:
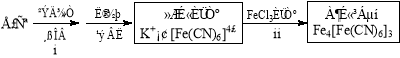
复分解反应ii的离子方程式是 。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN,方案如下:
![]()
若试纸变蓝则证明食品中含有CN,请解释检测时试纸中FeSO4的作用 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com