
某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A.正极反应式为:O2+2H2O+4e-=4OH-
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2=2H2O
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
[双选题]在25℃某稀溶液中,由水电离产生的c(H+)=10-13 mol·L-1,下列有关溶液的叙述正确的是( )
A.该溶液一定呈酸性
B.该溶液一定呈碱性
C.该溶液的pH可能约为1
D.该溶液的pH可能约为13
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(解析版) 题型:实验题
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计] 控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
实验编号 | 实验目的 | T/K | pH | c/10-3 mol·L-1 | |
H2O2 | Fe2+ | ||||
① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
② | 探究温度对降解反应速率的影响 |
|
|
|
|
③ |
| 298 | 10 | 6.0 | 0.30 |

[数据处理] 实验测得p-CP的浓度随时间变化的关系如上图。
(2)请根据上图实验①曲线,计算降解反应50~150 s内的反应速率:
v(p-CP)=________mol·L-1·s-1。
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:_____________________________
(4)实验③得出的结论是:pH等于10时,________。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(解析版) 题型:选择题
[双选题]实验室用锌粒与2 mol·L-1硫酸溶液制取氢气,下列措施不能增大化学反应速率的是( )
A.向该硫酸溶液中加入等体积的水
B.改用3 mol·L-1盐酸
C.改用热的2 mol·L-1硫酸溶液
D.用锌粉代替锌粒
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题1 化学反应与能量变化练习卷(解析版) 题型:填空题
(1)1.00 L 1.00 mol·L-1 H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ热量,表示生成1 mol H2O的热化学方程式为_________________________
(2)在25 ℃、101 kPa时,1.00 g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8 kJ的热量,C6H6的标准燃烧热为____________kJ·mol-1,该反应的热化学方程式为_______________________________________________
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题1 化学反应与能量变化练习卷(解析版) 题型:选择题
沼气是一种能源,它的主要成分是CH4,0.5 mol CH4完全燃烧生成CO2和H2O(l)时,放出445 kJ热量,则下列热化学方程式中正确的是( )
A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)ΔH=+890 kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=+890 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890 kJ/mol
D. CH4(g)+O2(g)=
CH4(g)+O2(g)= CO2(g)+H2O(l)ΔH=-890 kJ/mol
CO2(g)+H2O(l)ΔH=-890 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014年高中化学人教版选修四第四章 电化学基础练习卷(解析版) 题型:填空题
如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
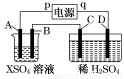
(1)p为 极,A极发生了 反应。
(2)C为 极,可收集到 ;D为 极,可收集到 。
(3)C极的电极反应式为 。
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如下表:
时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
阴极产生气体 的体积(cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
阳极产生气体 的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析以上实验数据,请说出变化的可能原因是
。
(5)当反应进行一段时间后,A、B电极附近溶液的pH (填“增大”“减小”或“不变”)。
(6)当电路中通过0.004 mol电子时,B极上沉积的金属X为0.128 g,则此金属的摩尔质量为 。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学人教版选修四第四章 电化学基础练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.铅蓄电池放电时铅电极发生还原反应
B.电解饱和食盐水在阳极得到氯气,阴极得到金属钠
C.给铁钉镀铜可采用CuSO4作电镀液
D.生铁浸泡在食盐水中发生析氢腐蚀
查看答案和解析>>
科目:高中化学 来源:2014年高中化学人教版选修四第三章 水溶液中的离子平衡练习卷(解析版) 题型:选择题
下列水溶液一定呈中性的是( )
A.c(NH4+)=c(Cl-)的NH4Cl溶液
B.c(H+)=1.0×10-7 mol·L-1的溶液
C.pH=7的溶液
D.室温下将pH=3的酸与pH=11的碱等体积混合后的溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com