
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。查阅资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。②Cl2与KOH溶液在20 ℃以下反应生成KClO,在较高温度下则生成 KC1O3。
(1)用K2FeO4处理生活用水既可以消毒又可以沉降,其原理是K2FeO4与水反应生成Fe(OH)3 胶体,写出该反应的离子方程式:____________________________。
(2)实验室常利用氯气制备NaClO后与NaOH、Fe(NO3)3反应制备K2FeO4根据反应原理,仅根据下列仪器,请你组装合理、简洁的实验装置,所用的装置的接口连接顺序:___________________________。

(3)写出装置A中发生的离子方程式: ______________________ 。
(4)三颈烧瓶用冰水浴的原因是 _________________,A处盛放KC1O3的仪器名称 ___________。
(5)将实验得到的Na2FeO4再加入饱和KOH溶液中,可析出紫黑色的K2FeO4粗晶体,其原因是________________________________________________________。
(6)高铁酸钾纯度检测:称取3.0 g制备的K2FeO4粗晶体溶于适量KOH溶液中,加入足量的KCrO2充分反应(此时Cr元素全部以CrO42- 形式存在),过滤,滤液在100 mL容量瓶中定容。取10.00 mL加人稀硫酸酸化,再用 0.10 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点(此时Cr元素全部以Cr3+形式存在),重复滴定3次,平均消耗(NH4)2Fe(SO4)2溶液的体积为24.00 mL,则该K2FeO4样品的纯度为_________。
【答案】4FeO42- +10 H2O = 4Fe(OH)3 (胶体) + 8OH- + 3O2 ↑ adebcj (或adecbj) ClO3- +6H+ +5Cl-=3Cl2↑+3H2O 防止Cl2与KOH反应生成KClO3而得不到KClO 圆底烧瓶 相同条件下,K2FeO4的溶解度小于Na2FeO4的溶解度(说法合理即可) 52.8%
【解析】
(1)由题可知,K2FeO4与水反应生成Fe(OH)3 胶体,Fe元素化合价降低,根据化合价升降规则可知,O元素化合价升高,生成氧气,根据化合价升降守恒、原子守恒、电荷守恒可写出其离子方程式为:4FeO42- +10H2O = 4Fe(OH)3 (胶体) + 8OH- + 3O2 ↑;
(2)装置A为制备氯气装置,B为制备NaClO后与NaOH、Fe(NO3)3反应制备Na2FeO4的装置,装置C为除去氯气中氯化氢装置,装置D为气体干燥装置,装置E为安全瓶或储存气体装置,装置F为除尾气装置,
根据实验要求,本实验需要装置为A、B、C、F,装置A制备的氯气经过除氯化氢后,通入装置B中进行反应制备Na2FeO4,未反应完全的气体经过尾气处理,故装置的接口连接顺序为:adebcj (或adecbj);
(3)装置A为制备氯气装置,KClO3与浓盐酸反应的离子方程式为:ClO3- +6H+ +5Cl-=3Cl2↑+3H2O;
(4)因该反应为放热反应,而Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成 KC1O3,因此需要用冰水浴保持反应温度在20℃以下,防止Cl2与KOH反应生成KClO3而得不到KClO;根据仪器图可知,盛放KClO3的仪器为圆底烧瓶;
故答案为:防止Cl2与KOH反应生成KClO3而得不到KClO;圆底烧瓶;
(5)由K2FeO4微溶于KOH溶液可知,K2FeO4在KOH溶液中溶解度小于Na2FeO4,因此将实验得到的Na2FeO4再加入饱和KOH溶液中,可析出紫黑色的K2FeO4粗晶体,
故答案为:相同条件下,K2FeO4的溶解度小于Na2FeO4的溶解度;
(6)由反应方程式:a、FeO42+CrO2+2H2O=CrO42+Fe(OH)3↓+OH、
b、2CrO42+2H+=Cr2O72+H2O、
c、Cr2O72+6Fe2++14H+=2Cr3++6Fe3++7H2O
可得关系式:FeO42CrO2![]() Cr2O723Fe2+,
Cr2O723Fe2+,
则每次滴定反应的K2FeO4的物质的量为:n(K2FeO4)=![]() ( Fe2+)=
( Fe2+)=![]() ×24.00×10-3L×0.1mol/L=8×10-4mol,
×24.00×10-3L×0.1mol/L=8×10-4mol,
则K2FeO4的总质量为:198g/mol×8×10-4mol×![]() =1.584g,
=1.584g,
则K2FeO4的样品纯度为:![]() ×100%=52.8%。
×100%=52.8%。


科目:高中化学 来源: 题型:
【题目】利用图示装置进行实验,反应进行足够长时间后装置II中实验现象正确的是
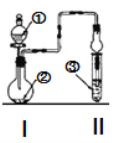
① | ② | ③ | II中实验现象 | |
A | 浓盐酸 | 大理石 | 氯化钡溶液 | 产生大量白色沉淀 |
B | 浓氨水 | 碱石灰 | 硫酸亚铁溶液 | 产生大量白色沉淀 |
C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 |
D | 浓盐酸 | KMnO4 | 氢硫酸 | 产生淡黄色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的叙述正确的是( )
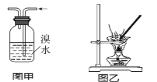
A.将Cl2通入KI淀粉溶液中,溶液先变蓝后褪色,说明Cl2有漂白性
B.图甲用于除去乙烯中的SO2
C.用图乙装置蒸干明矾溶液制KAl(SO4)2·12H2O晶体
D.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A、C、E是常见的金属单质,E为紫红色,反应①可用于焊接铁轨,B是赤铁矿的主要成分,F的溶液中加入KSCN溶液变红。(部分反应物和生成物省略)
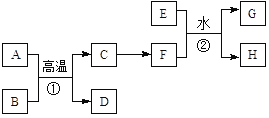
请回答下列问题:
(1)D的化学式是________。
(2)可选用________(填“字母”)实现反应C→F的转化。
a.稀盐酸 b.氯气/点燃 c.CuSO4溶液
(3)反应①的化学方程式为____________。
(4)反应②的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置(固定及夹持装置、加热仪器和橡胶管略)进行有关氨气制取的实验探究。

回答下列问题:
(1)若用装置①制取NH3,其反应的化学方程式为__________;若要测定生成的NH3的体积,则必须选择的装置是__________(填装置序号),装置中所盛试剂应具有的性质是__________。
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是__________,分液漏斗中装的试剂是__________,收集装置应选择__________(填装置序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置应用于制取、干燥NH3、验证NH3还原性、吸收过量NH3并防止倒吸,其中能达到实验目的的是
A. 制取NH3  B. 干燥NH3
B. 干燥NH3 
C. 验证还原性 D. 吸收尾气
D. 吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法正确的是

A. a点时溶液中阳离子仅为Cu2+和Fe2+
B. b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C. c点时溶液中溶质的物质的量浓度为0.5 mol·L-1
D. 原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是一种临床常用的基本药物,有广泛的用途,其合成路线如下:
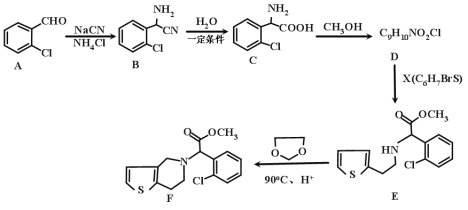
(1)A的化学名称是________,B的分子式是_____________。
(2)C中含氧官能团的名称为________。)
(3)请写出 C→D 的化学方程式为___________,其反应类型是________。
(4)G是C的同系物,且少一个碳原子,则G的结构有_____种。
(5)X的结构简式为___________。
(6)已知: ,则由乙烯、甲醛为有机原料制备化合物
,则由乙烯、甲醛为有机原料制备化合物![]() ,请写出合成路线________(无机试剂任选)
,请写出合成路线________(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E四种元素,它们原子的核电荷数均小于18,且依次递增,A原子核内仅有一个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D的最外层电子数是次外层电子数的3倍;E的单质是用途最广泛的半导体材料。试推断它们各是什么元素并回答下列问题:
(1)写出它们的元素符号:A________,B________,C________,D________,E________。
(2)B、C、D的气态氢化物的稳定性由大到小的顺序为__________(用化学式表示)
(3)画出D的离子结构示意图________。
(4)用一个方程式证明B、E的非金属性的强弱_______________。
(5)写出E的最高价氧化物的一种用途:_________。
(6)由这五种元素组成的三核10电子的分子为________,四核10电子的分子是________。由这五种元素组成的四核18电子的分子为________,五核18电子的分子是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com