
【题目】实验室中保存下列化学药品的方法不妥当的是( )
A. 将AgNO3晶体放在棕色试剂瓶中
B. NaOH溶液保存在带橡胶塞的细口试剂瓶中
C. 金属钾、钠和非金属白磷保存在煤油中
D. 浓硝酸溶液保存在棕色试剂瓶中
科目:高中化学 来源: 题型:
【题目】某学生用碱式滴定管量取NaOH溶液,开始时仰视液面,读数为5.00 mL,取出部分溶液后,俯视液面,读数为15.00 mL,该同学在操作中实际取出的液体为
A.大于10.00 mL B.小于10.00 mL C.等于10.00 mL D.等于11.00 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z均为短周期元素,X元素的气态氢化物的水溶液滴入无色酚酞变红,Y元素的最外层电子数是次外层电子数的2倍,Z元素是短周期元素中原子半径最大的元素(He、Ne、Ar除外)。
(1)写出X的元素符号 ,其原子结构示意图为 。
(2)元素Y的最简单氢化物的化学式 。
(3)Z元素的最高价氧化物对应的水化物的电子式为 。
(4)X元素最高价氧化物对应的水化物与氧化铝反应的离子方程式为 。
(5)Y元素的最高价氧化物和Z元素的过氧化物发生氧化还原反应的化学方程式为 。
(6)在2 L密闭容器中进行下列反应:CO2(g)+C(s)![]() 2CO(g) ΔH>0 (吸热),其他条件不变,只改变下列某一反应条件,分析化学反应速率的变化趋势并进行相关计算。
2CO(g) ΔH>0 (吸热),其他条件不变,只改变下列某一反应条件,分析化学反应速率的变化趋势并进行相关计算。
①增加C,化学反应速率 (填“增大”、“减小”或“不变”)
②减小密闭容器的体积,化学反应速率 (填“增大”、“减小”或“不变”)
③若起始时将2 mol CO充入容器发生反应,2S后测得CO2为0.6 mol,则2S内CO的平均反应速率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中发生如下反应:A(g)+3B(g)![]() 2C(g) ΔH<0,根据下列速率-时间图像,回答下列问题:
2C(g) ΔH<0,根据下列速率-时间图像,回答下列问题:
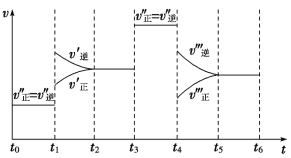
(1)下列时刻所改变的外界条件是:t1___________;t3___________;t4___________;
(2)产物C的体积分数最大的时间段是_______________;A的物质的量最大的时间段是
(3)反应速率最大的时间段是___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂【主要成分为Al(OH)2Cl】的一种工艺如下:
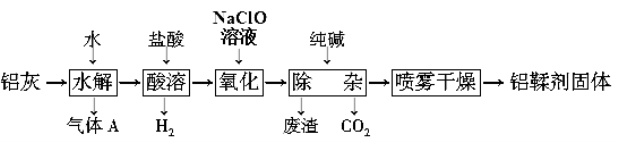
⑴气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为: 。
⑵“酸溶”时,Al2O3发生反应的离子方程式为: 。
⑶“氧化”时,发生反应的离子方程式为: 。
⑷“废渣”成分为________(填化学式)。
⑸采用喷雾干燥而不用蒸发的原因是______________________。
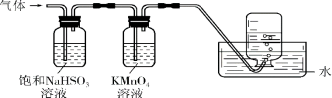
⑹煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O
将产生的气体通过如下图所示的装置。则集气瓶中收集到的气体是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.5mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
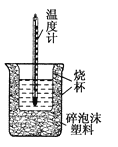
(1)从实验装置上看,图中尚缺少一种玻璃仪器是__________。
(2)大烧杯上如不盖硬纸板,测得的中和热________(填“偏大”或“偏小”或“无影响”)。
(3)实验中改用60mL 0.50mol·L-1盐酸跟50mL 0.50mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“偏大”或“相等”或“偏小”),所求中和热________(填“相等”或“不相等”),简述理由:_________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________;用50mL 0.5mol·L-1盐酸与50mL 0.50mol·L-1 NaOH溶液进行中和测定,测得的中和热数值会________。(填“偏大”、“偏小”或“无影响”)
(5)取50 mL 0.50 mol/L NaOH溶液和30 mL0.50 mol/L硫酸溶液进行实验,实验数据如下表。
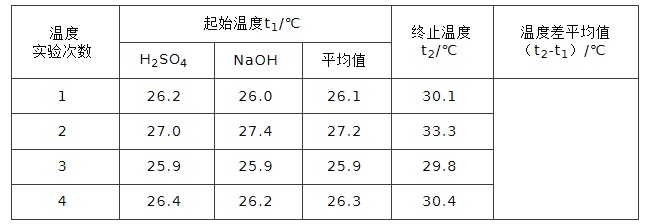
则中和热ΔH= (取小数点后一位)。(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃))
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com