
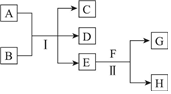
 A~H为中学化学中几种常见物质,它们之间的转化关系如图所示.常温下,A和G均为单质气体,同体C常用作干燥剂,E为无色、无味的液体,F为淡黄色粉末.回答下列问题:
A~H为中学化学中几种常见物质,它们之间的转化关系如图所示.常温下,A和G均为单质气体,同体C常用作干燥剂,E为无色、无味的液体,F为淡黄色粉末.回答下列问题:分析 E常温下为无色无味的液体,应为H2O,F为淡黄色粉末,能与水反应,则为Na2O2,所以H为NaOH,G为O2,又C常用作干燥剂即CaCl2,A为单质气体,则A与B反应生成C,即Cl2和Ca(OH)2反应,所以A为Cl2,B为Ca(OH)2,D为Ca(ClO)2,据此分析解答.
解答 解:(1)由以上分析可知F的化学式为Na2O2,G为O2,反应Ⅱ为过氧化钠和水的反应,反应中过氧化钠自身发生氧化还原反应,O元素化合价由-1价分别变为0价、-2价,生成1molO2,转移2mol电子,数目为1.204×1024(或2NA),故答案为:Na2O2;1.204×1024(或2NA);
(2)由以上分析可知,反应Ⅰ为Cl2和Ca(OH)2反应,所以化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
点评 本题考查无机物的推断,为高频考点,侧重考查学生的分析能力,题目难度中等,以物质的颜色和化学性质等为突破口进行推断,侧重考查元素化合物性质,学习中注意把握.


科目:高中化学 来源: 题型:选择题
| A. | 新制氯水放在棕色试剂瓶中,避光保存 | |
| B. | 液溴密封盛放在棕色瓶中,液面上放一层水 | |
| C. | 少量金属钠保存在四氯化碳中 | |
| D. | 水玻璃保存在带胶塞的玻璃试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | Al3+、Ba2+ |
| 阴离子 | OHˉ、SO42ˉ、Clˉ |
| A. | 往甲和乙的混合溶液中加入过量的丁溶液一定会生成白色沉淀 | |
| B. | 丙和丁的水溶液混合后会生成白色沉淀 | |
| C. | 一定温度下,丙溶于水会使水的电离程度增大 | |
| D. | 一定温度下,甲溶于水会使水的电离程度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
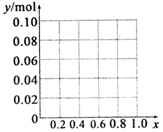
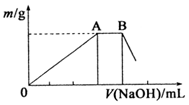 铝及其化合物在生产和生活等方面有广泛的应用.请回答下列问题:
铝及其化合物在生产和生活等方面有广泛的应用.请回答下列问题: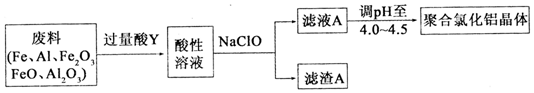
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3是氧化剂 | B. | P2O5是氧化产物 | ||
| C. | 1molKClO3参加反应有6mole-转移 | D. | 每有6molP被还原,生成5molKCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
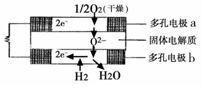 固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )| A. | 该电池的总反应方程式为:2H2+O2=2H2O | |
| B. | 电子由a极流向b极 | |
| C. | a极对应的电极反应式为2H2O+O2-4e=4OH- | |
| D. | 有O2参加反应的a极为电池的阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{2}$H | B. | ${\;}_{1}^{3}$H | C. | ${\;}_{2}^{4}$He | D. | ${\;}_{1}^{1}$H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | Y的简单气态氢化物的热稳定性比W的弱 | |
| C. | 由X、Y组成的物质与由Y、W组成的物质化合,可能发生氧化还原反应 | |
| D. | 常温下,Z的单质一定易溶于由X、Y、W三种元素组成的化合物的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(W)>r(Z)>r(Y) | |
| B. | Z的最高价氧化物对应水化物的碱性比W的强 | |
| C. | 化合物X2Y2和Z2Y2所含化学键类型完全相同 | |
| D. | 工业上常用电解熔融W的氧化物制备W的单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com