
分析 烧瓶质量增重的4.32g为析出Ag的质量,其物质的量为0.04mol,醛的质量为:10g×11.6%=1.16g,若为甲醛,则甲醛为0.01mol,其质量为0.01mol×30g/mol=0.3g<1.16g,不能是甲醛,该醛的组成为R-CHO,由R-CHO~2Ag计算醛的物质的量,进而确定其分子式.
解答 解:烧瓶质量增重的4.32g为析出Ag的质量,其物质的量为:$\frac{4.32g}{44g/mol}$=0.04mol,醛的质量为:10g×11.6%=1.16g,若为甲醛,由HCHO~4Ag,则甲醛为0.01mol,其质量为0.01mol×30g/mol=0.3g<1.16g,不可能为甲醛,
该醛的分子式为CnH2nO,
R-CHO~2Ag
1mol 2mol
0.02mol 0.04mol
故醛的相对分子质量为:$\frac{1.16}{0.02}$=58,去掉1个-CHO后剩余原子总相对原子质量为58-29=29,剩余基团中最大碳原子数目为:$\frac{29}{12}$=2…5,该醛的分子式为C3H6O,结构简式为CH3CH2CHO,名称是丙醛,
答:醛结构简式为CH3CH2CHO,名称是丙醛.
点评 本题考查有机物分子式确定的计算,题目难度中等,根据醛基与Ag的物质的量关系计算醛的相对分子质量为解答关键,试题有利于培养学生的分析能力及化学计算能力.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:选择题
| A. | 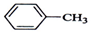 +Cl2$\stackrel{光照}{→}$ +Cl2$\stackrel{光照}{→}$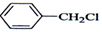 +HCl +HCl | |
| B. | 2CH3CH2+O2$→_{△}^{Cu}$2CH3CHO+2H20 | |
| C. | ClCH2=CH2+NaOH $→_{△}^{H_{2}O}$ HOCH2CH=CH2+NaCl | |
| D. | 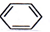 +HONO2 $→_{△}^{浓硫酸}$ +HONO2 $→_{△}^{浓硫酸}$ 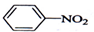 +H2O +H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下pH=11的氨水中,由水电离产生的c(OH-)=10-11mol/L | |
| B. | pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合后的溶液中,c(H+)>c(OH-) | |
| C. | NaHCO3溶液中,存在c(H+)=c(OH-)+c(${CO}_{3}^{2-}$) | |
| D. | 0.1 mol/L的NH4Cl溶液中:c(Cl-)>c(${NH}_{4}^{+}$)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
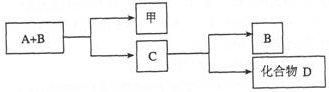
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
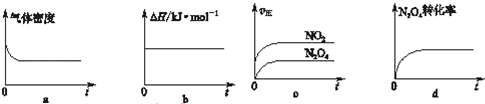
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在海轮外壳上镶锌块,可减缓船体的腐蚀 | |
| B. | 钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气最终转化为铁锈 | |
| C. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| D. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com