
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
. 4NO+6H2O.
4NO+6H2O. 分析 据元素周期表的结构可推出,表中所是元素分别是:①C ②N ③F ④Mg ⑤Al ⑥S ⑦Cl ⑧Ar ⑨K ⑩Br,
(1)最不活泼的元素是稀有气体,位于元素周期表的0族;
(2)两性氢氧化物是指既能与酸又能与碱反应,生成盐与水的物质;
(3)根据元素性质的递变规律,金属性强的元素位于元素周期表的“左、下”,非金属性强的元素位于元素周期表的“右、上”.所以金属性K>Mg>Al,非金属性C<S<Cl;元素的金属性越强,其最高价氧化物的水化物的碱性就越强,元素的非金属性越强,其最高价氧化物的水化物的酸性就越强;
(4)③⑩元素是同主族元素,所以两者核电荷数之差是8+18=26;
(5)②元素位于第二周期第ⅤA族,是氮元素,它的氢化物是NH3.
解答 解:根据元素周期表的结构可推出,表中所是元素分别是:①C ②N ③F ④Mg ⑤Al ⑥S ⑦Cl ⑧Ar ⑨K ⑩Br
(1)最不活泼的元素是稀有气体,位于元素周期表的0族,是表中的⑧氩元素,其原子结构示意图为: .
.
故答案为: ;
;
(2)表中形成两性氢氧化物的是Al(OH)3,对应的元素是铝;⑨元素是钾,对应的最高价氧化物的水化物是KOH,铝与氢氧化钾反应的离子方程式是:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:铝 2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)根据元素性质的递变规律,金属性强的元素位于元素周期表的“左、下”,非金属性强的元素位于元素周期表的“右、上”.所以金属性K>Mg>Al,非金属性C<S<Cl;元素的金属性越强,其最高价氧化物的水化物的碱性就越强,元素的非金属性越强,其最高价氧化物的水化物的酸性就越强,按碱性减弱酸性增强的顺序排列是:KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4
故答案为:KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4;
(4)第三周期有8种元素,第四周期有18种元素,③⑩元素是同主族元素,所以两者核电荷数之差是8+18=26.
故答案为:26;
(5)②元素位于第二周期第ⅤA族,是氮元素,它的氢化物是NH3,发生催化氧化的化学方程式是4NH3+5O2  4NO+6H2O.
4NO+6H2O.
故答案为:4NH3+5O2  4NO+6H2O.
4NO+6H2O.
点评 本题较基础,需要熟练掌握元素周期表中的1-36号元素的位置与特点,综合应用元素性质解答此类题目,注意按题目要求作答.


科目:高中化学 来源: 题型:解答题
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
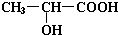 ;
;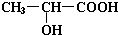 ,该六元环酯的结构简式为
,该六元环酯的结构简式为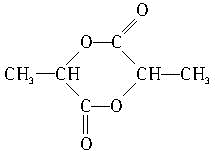 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
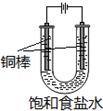 CuCl是应用广泛的有机合成催化剂,可采取不同方法制取.
CuCl是应用广泛的有机合成催化剂,可采取不同方法制取. [CuCl3]2-(无色溶液)逆向移动,生成CuCl.
[CuCl3]2-(无色溶液)逆向移动,生成CuCl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
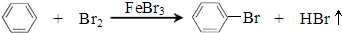
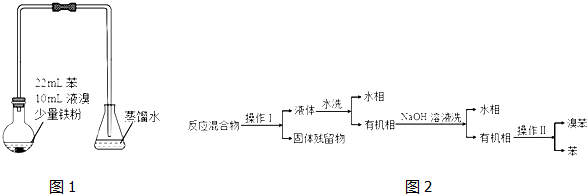
| 沸点℃ | 密度g/cm3 | 溶解性 | |
| 溴 | 59 | 3.119 | 水中溶解度小,易溶于有机溶剂 |
| 苯 | 80 | 0.8765 | 难溶于水,与有机溶剂互溶 |
| 溴苯 | 156 | 1.50 | 难溶于水,与有机溶剂互溶 |
| 序号 | 实验步骤 | 预期现象 | 结论 |
| 1 | 将锥形瓶中液体转入分液漏斗,加入适量四氯化碳,振荡后分液.分别取少量上层无色溶液于试管A、B中 | ||
| 2 | 锥形瓶中液体含大量 Br- | ||
| 3 | 锥形瓶中液体含大量 H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
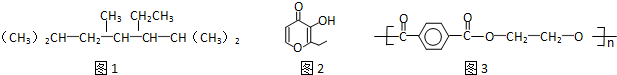
| A. | 按系统命名法命名时,(图1)化合物的名称是2,4,6-三甲基-3-乙基庚烷 | |
| B. | 有机物(图2)的一种芳香族同分异构体能发生银镜反应 | |
| C. | 高分子化合物(图3),其单体为对苯二甲酸和乙醇 | |
| D. | 前期在西非国家爆发的埃博拉疫情极具蔓延之势,已知该病毒对化学药品敏感.乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15g甲基(-CH3)所含的电子数为9NA | |
| B. | 300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA | |
| C. | 标准状况下,22.4LCH4气体与足量Cl2反应可生成NA个CH3Cl分子 | |
| D. | 80mL 10mol/L浓盐酸与足量MnO2反应,转移电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y、P的简单氢化物中化学键类型相同 | |
| B. | 原子半径:X>Y | |
| C. | 最高价氧化物的水化物酸性:P<Q | |
| D. | X、Q两元素的最高正化合价相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com