


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
| A、32 | B、16 | C、8 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有NA个氧原子的氧气在标准状况下的体积约为22.4L |
| B、2L 0.3mol?L-1的硫酸钾溶液中钾离子浓度为1.2mol?L-1 |
| C、常温常压下,32g O2和O3的混合气体所含原子数为2NA |
| D、25℃,1.01×105Pa,64g SO2中含有的原子个数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、H+、Na+、
| ||||
B、Na+、H+、
| ||||
C、K+、
| ||||
D、Ca2+、Na+、Cl-、
|
查看答案和解析>>
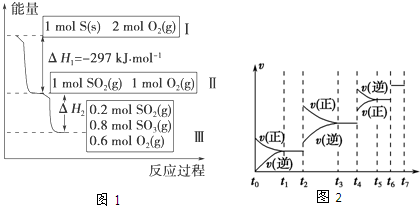
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
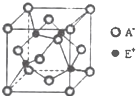 己知A、B、C、D、E、F六种元素均位于前四周期,其有关结构或性质信息如表所示:
己知A、B、C、D、E、F六种元素均位于前四周期,其有关结构或性质信息如表所示:| 元素 | 有关结构或性质信息 |
| A | A的某同位素原子的质子数与中子数相等,应用于核聚变反应 |
| B | 其最高价氧化物的水化物是强酸,能与其氢化物反应生成盐 |
| C | 基态原子核外s能级上的电子数是p能级上电子数的2倍 |
| D | 所组成的单质和氢化物中分别有一种具有漂白性 |
| E | E+离子的各层电子均充满,E2+离子与BA3形成的离子水溶液呈深蓝色 |
| F | F3+基态离子的能级为半充满结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
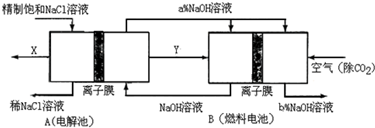
查看答案和解析>>
科目:高中化学 来源: 题型:
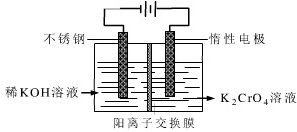
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com