
某无色透明溶液能与铝粉反应放出H2,则此溶液中一定能大量共存的离子组是( )
A.Na+ Cl- CO32- Cu2+ B.Na+ Cl- K+ SO42-
C.SO42- Mg2+ Ba2+ Cl- D.Na+ Cl- K+ HCO3-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年甘肃省高二上阶段考二化学卷(解析版) 题型:填空题
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。
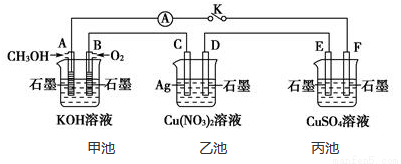
请回答下列问题:
(1)甲池为 (填“原电池”、“电解池”或 “电镀池”),A电极的电极反应式为 。
“电镀池”),A电极的电极反应式为 。
(2)丙池中F电极为 (填“正极”、“负极”、“阴极”或“阳极”),该池的总反应方程式为 。
(3)当池中D极质量增重10.8 g时,甲池中B电极理论上消耗O2的体积为 mL(标准状况)。
(4)已知丙池中的溶液为400 mL,合上开关K,一段时间后,丙池中,阳极共收集到气体224 mL(标况下)气体,则此时溶液的pH为 。
查看答案和解析>>
科目:高中化学 来源:2017届吉林省吉林市高三毕业班第一次调研测化学试卷(解析版) 题型:选择题
下列化合物中既能发生加成反应,又能使KMnO4酸性溶液褪色的是
A.甲烷 B.乙醇 C.丙烯 D.苯
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一上月考三化学卷(解析版) 题型:填空题
重大科技进展中的其中一项为:储氢碳纳米管研究获重大进展,用电弧法合成碳纳米管, 常伴有大量杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化汽化法提纯。其反应式为:
常伴有大量杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化汽化法提纯。其反应式为:
K2Cr2O7+C+H2SO4→Cr2(SO4)3+K2SO4+H2O+CO2↑
(1)配平上述反应的化学方程式
K2Cr2O7 + C + H2SO4 = Cr2(SO4)3 + K2SO4 + H2O + CO2↑
(2)此反应的氧化剂为 ;氧化产物是 。(填化学式)
(3)要使10mL 1.0 mol·L-1的K2Cr2O7溶液被还原,至少要加入 ml2.0 mol·L-1的H2SO4溶液。
(4)H2SO4在上述反应中表现出来的性质是 (填选项编号)
A.酸性 B.氧化性 C.吸水性 D.还原性
(5)在配平H2O2、KMnO4、H2SO4三者反应的化学方程式时,出现多套配平系数,如:
a.7H2O2+2KMnO 4+3
4+3 H2SO4=2MnSO4+6O2↑+K2SO4+10H2O
H2SO4=2MnSO4+6O2↑+K2SO4+10H2O
b.5H2O2+2KMnO4+3H2SO4=2MnSO4+5O2↑+K2SO4+8H2O
c.9H2O2+2KMnO4+3H2SO4=2MnSO4+7O2↑+K2SO4+12H2O
用H218O2进行示踪实验(18O为示踪原子),证实生成的氧气全部是18O2,仅据这一实验事实,回答下列问题:
H2O2仅起还原剂作用的化学方程式是 (填序号a、b、c)。
研究三个化学方程式各组系数的变化规律,写出符合该规律的一个新的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一上月考三化学卷(解析版) 题型:选择题
下列有关实验的说法正确的是( )
A.除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤
B.将钠投入到盛满水的烧杯中,观察钠与水反应实验现象
C.制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中
D.实验室配制一定浓度NaOH溶液,将称量固体溶解后马上转移到容量瓶中
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一上月考三化学卷(解析版) 题型:选择题
金属的使用是人类拓展自身能力的标志之一。人类利用几种常用金属的先后顺序依次为金、铜、铁、铝,之所以有先后,主要取决于( )
A. 金属在地壳中的含量多少 B. 金属的熔沸点高低
C. 金属的活泼性强弱 D. 金属的导电性强弱
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:填空题
计算题
(1)3.01×1023个OH-含有质子的物质的量是 mol,含有电子的物质的量是 mol;
(2)200mL 2mol/L的Al2(SO4)3溶液中SO42﹣的物质的量浓度为 mol/L;
(3 )标准状况下,36g H2和O2组成的混合气体的体积是67.2L。求这种混合气体中H2和O2的体积
)标准状况下,36g H2和O2组成的混合气体的体积是67.2L。求这种混合气体中H2和O2的体积
比 ,混合气体的平均摩尔质量为 ;
(4)市售盐酸试剂中溶质的质量分数为36.5%,密度为1.18g/ml,该盐酸的物质的量浓度是 mol/L 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:填空题
Ⅰ.甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡 常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1) 据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。500 ℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正__________v逆(填“>”、“=”或“<”)。
(2) 对于反应③,在相 同温度和容积不变时,能说明该反应已达平衡状态的是
同温度和容积不变时,能说明该反应已达平衡状态的是
A.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C. H2的消耗速
H2的消耗速 率与CH3OH的消耗
率与CH3OH的消耗 速率之比为3∶1
速率之比为3∶1
D.容器内的密度保持不变
Ⅱ.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO(g)+2CO(g) 2CO2(g)+N2(g)ΔH<0
2CO2(g)+N2(g)ΔH<0
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 1.00×10-3 | 4.50×10- 4 | 2.50×10- 4 | 1.50×10- 4 | 1.00×10- 4 | 1.00×10- 4 |
c(CO)(mol/L) | 3.60×10- 3 | 3.05×10- 3 | 2.85×10- 3 | 2.75×10- 3 | 2.70×10- 3 | 2.70×10- 3 |
请回答下列问题(均不考虑温度变化 对催化剂催化效率的影响):
对催化剂催化效率的影响):
(1)前2s内的平均反应速率υ(N2)= ,CO的平衡转化率为____________。(结果均保留两位有效数字)
(2)写出该反应的平衡常数K的表达式________________。
(3)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。某同学设计了三组实验,实验条件已经填在下面实验设计表中。
实验 编号 | T(℃) | NO初始浓 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
①以上三组实验的实验目的是_______________________。
②请在给出的坐标图中,画出上表中的第三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图。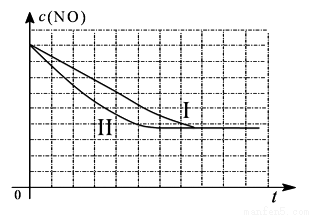
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上阶段考二文化学卷(解析版) 题型:填空题
下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明。请根据此表,结合化学和生物学科的知识,回答下列问题。
配料表 | 精制海盐、碘酸钾 |
含碘量 | 20~40mg/kg |
卫生许可证号 | ××卫碘字(1999)第001号 |
分装日期 | 见封底 |
储藏方法 | 密封、避光、防潮 |
食用方法 | 烹调时,待食品熟后加入碘盐 |
(1)要在食盐中加碘,是因为碘是人体内合成____________激素的主要原料,缺碘会引起疾病。
(2)食盐中加碘,这碘指的是 (填化学式),其中碘元素的化合价为______________。
(3)根据含碘盐的食用方法,可推测碘酸钾在受热时容易___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com