
| A. | 4.48L | B. | 5.6L | C. | 6.72L | D. | 8.96L |
分析 该混合液中含有:n(H+)=0.5mol×2=1mol,n(NO3-)=0.3mol,首先发生反应:3Mg+2NO3-+8H+=3Mg2++2NO↑+4H2O,Mg的质量为7.2g,物质的量为:$\frac{7.2g}{24g/mol}$=0.3mol,由离子方程式可知,0.3mol硝酸根离子完全反应消耗1.2氢离子、0.45Mg,显然Mg,反应只生产NO气体,根据Mg的物质的量计算出生成NO气体的物质的量,最后根据V=nVm计算出生成NO的体积.
解答 解:混合液中含有:n(H+)=0.5mol×2=1mol,n(NO3-)=0.3mol,首先发生反应:3Mg+2NO3-+8H+=3Mg2++2NO↑+4H2O,Mg的质量为14.4g,物质的量为:$\frac{7.2g}{24g/mol}$=0.3mol,
3Mg+2NO3-+8H+=3Mg2++2NO↑+4H2O,
3 2 8 2
0.3mol n(NO3-)n(H+)
0.3molMg完全反应消耗硝酸根离子为:n(NO3-)=$\frac{0.3mol×2}{3}$=0.2mol,消耗氢离子为:n(H+)=$\frac{0.3mol×8}{3}$=0.8mol,
显然硝酸根离子、氢离子过量,金属Mg不足,
根据电子守恒,0.3molMg完全反应生成NO的物质的量为:n(NO)=$\frac{0.3mol×2}{5-2}$=0.2mol
标准状况下0.2molNO的体积为:22.4L/mol×0.2mol=4.48L,
故选A.
点评 本题考查混合物反应的计算、反应物过量计算,题目难度中等,明确发生反应的实质为解答关键,注意根据反应方程式正确判断反应物过量情况的方法,试题培养了学生的化学计算能力.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
| 正反应速率 | 逆反应速率 | |
| A | vA=2 mol/(L•min) | vB=2 mol/(L•min) |
| B | vA=2 mol/(L•min) | vC=2 mol/(L•min) |
| C | vA=1 mol/(L•min) | vB=2 mol/(L•min) |
| D | vA=1 mol/(L•min) | vC=1.5 mol/(L•min) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
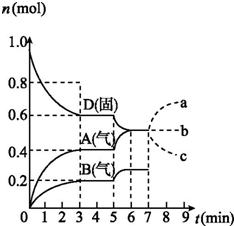 在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )
在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )| A. | 从反应开始到第一次达到平衡时,B物质的平均反应速率为0.033 3 mol/(L•min) | |
| B. | 根据右图该反应的平衡常数表达式为K=c2(A)•c(B) | |
| C. | 若在第5 min时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大 | |
| D. | 若在第7 分钟时增加D的物质的量,A的物质的量变化情况符合a曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
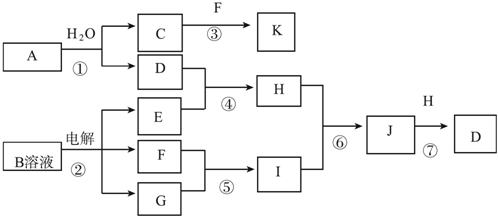
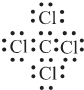 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
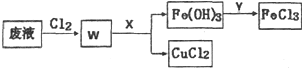 铜及其化合物在工农业生产中有着广泛的用途.
铜及其化合物在工农业生产中有着广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
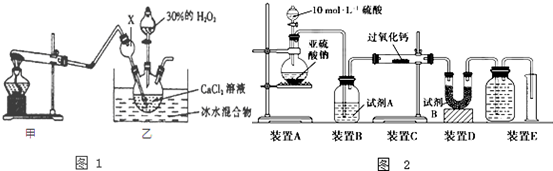
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
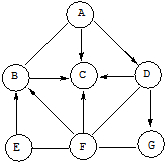 则原混合物中E、G的物质的量之比为1:1.
则原混合物中E、G的物质的量之比为1:1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com