
【题目】测定硫酸铜晶体(![]() )中x值的实验过程如下:
)中x值的实验过程如下:

(1)从下列仪器中选出所需仪器(用标号字母填写)_______________________。
A. 电子天平 B. 试管夹 C. 酒精灯 D. 蒸发皿 E. 坩埚 F. 石棉网
(2)恒重操作时,连续两次称量的结果相差不超过_____g。
科目:高中化学 来源: 题型:
【题目】下列 3 种有机化合物 A: CH2=CH-CH3 B:![]() C:CH3CH2CH2OH
C:CH3CH2CH2OH
(1)写出化合物A、C 中的官能团的名称: _____、 ______。
(2)A在催化剂加热条件下生成聚合物的反应方程式:_____ 。
(3)C物质在一定条件下可转化为A,请写出其化学方程式: _____。
(4)B可与NaOH 溶液反应生成苯酚钠,写出向苯酚钠中通入二氧化碳的化学方程式为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,如图是苯乙烯的结构简式:![]() ,下列关于该有机物的说法不正确的是( )
,下列关于该有机物的说法不正确的是( )
A. 苯乙烯的分子式为C8H8
B. 苯乙烯通过加聚反应可制备高分子化合物
C. 苯乙烯与溴的四氯化碳溶液反应:![]()
D. 苯乙烯能发生加成反应,但不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中的28号元素Ni有重要的用途,它有良好的耐高温、耐腐蚀、防锈功能,在电池、催化剂方面也有广泛应用。工业上以硫化镍矿(含少量杂质硫化铜、硫化亚铁)为原料制备并精制镍的基本流程如下:
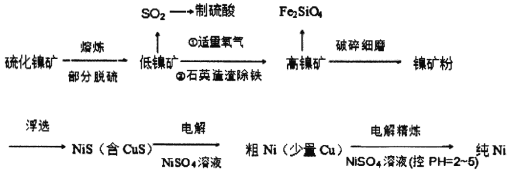
已知:电极电位(E)能体现微粒的氧化还原能力强弱,如:
H2-2e-=2H+ E=0.00V Cu-2e-=Cu2+ E=0.34V
Fe-2e-=Fe2+ E=-0.44V Ni-2e-=Ni2+ E=-0.25V
(1)镍在周期表中的位置为_______________________________。
(2)高镍矿破碎细磨的作用______________________________________。
(3)焰色反应实验可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,原因是______________________。
(4)造渣除铁时发生的化学反应方程式___________________________________(产物以氧化形式表示)。
(5)电解制粗镍时阳极发生的主要电极反应式_____________________________________。
(6)工业上由NiSO4溶液制得Ni(OH)2后,再滴加NaC1O溶液,滴加过程中发生反应的离子方程式为_________________________________________________________。
(7)电解精炼镍的过程需控制pH为2~5,试分析原因______________________________,阳极泥的成分为________________(写名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铝陶瓷常用于厚膜集成电路,制备氧化铝陶瓷的合成路线如图所示,回答下列问题。
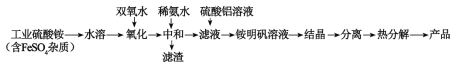
(1)“氧化”步骤发生的离子方程式为:___,使用双氧水作氧化剂优点为___:
(2)“热分解”得到的产物除了氧化铝外,还有NH3、N2、SO2、SO3、H2O生成,则氧化产物和还原产物的物质的量之比为___。
(3)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,“热分解”步骤中,其各温度段内受热“失重计算值”(失重计算值%=![]() ×100%)如表所示:
×100%)如表所示:
温度区间(℃) | 18→190 | 190→430 | 430→505 | 505→900 |
失重计算值(%) | 39.20 | 7.80 | 13.00 | 26.00 |
通过上述数据经粗略计算可判断,在温度区间___铵明矾基本上失去了全部结晶水。
(4)“结晶”步骤中常采用的操作是___。
(5)合成过程中常使用过量的工业硫酸铵,可利用硫酸铵溶液水解显酸性抑制硫酸铝水解,另外的一个重要作用是___。
(6)通常认为金属离子浓度等于1×10-5mol/L即可认为沉淀完全,试计算常温下“中和”步骤中需要调节溶液pH=___(保留一位小数,已知:Ksp[Fe(OH)3]=8.0×10-38,lg5=0.7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯等不饱和烃在有机化工领域有重要的用途,工业上常采用“丙烷脱氢法”制取丙烯,反应的原理为:C3H8(g)![]() C3H6(g)+H2(g) ΔH=+123kJ/mol
C3H6(g)+H2(g) ΔH=+123kJ/mol
回答下列问题:
(1)在石油工业中可通过___工艺获得丙烯等不饱和烃(填一种工艺的名称)。
(2)已知:
化学键 | C-H | C-C | C=C | H-H |
键能(kJ/mol) | 412 | 348 | a | 436 |
表中的a=___。
(3)工业上进行该反应时,常在丙烷中掺入稀有气体作为稀释剂,在体积可变的反应容器中,维持恒温,并使总压强恒定为0.1MPa,掺入稀有气体作为稀释剂的优点是___,试从平衡角度加以解释___。
(4)在某密闭容器中充入适量的丙烷,测得丙烷的转化率随温度和压强变化如图所示:
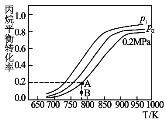
①压强p1___p2(填“>”、“<”或“=”)。
②图中A点平衡常数Kp=___(用平衡分压代替平衡浓度,分压=总压×物质的量分数,结果保留三位有效数字)。
③B点若达到A点所示的平衡状态则在建立平衡过程中v正___ v逆(填“>”、“<”或“=”)。
④写出一条提高丙烷平衡转化率的措施___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活和生产过程中化学有着重要的应用,下列有关说法正确的是![]()
A.洪涝、地震灾区灾后常用石灰对环境进行消毒,是利用石灰可使蛋白质变性的性质
B.食品添加剂对人体均有益,因此在添加时无需对其用量进行严格控制
C.生活中常见的石英玻璃、普通玻璃、钢化玻璃都属于硅酸盐产品
D.根据分散系的稳定性,将分散系分为溶液、胶体和浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[实验化学]
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的_________。
②萃取用到的分液漏斗使用前需_______并洗净,分液时有机层在分液漏斗的_____填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是______________;用饱和食盐水洗涤的目的是______________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_____(填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先_______,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,11.2 LHCl气体中含有的分子数为0.5NA
B. 常温常压下,5.6 g N2和CO混合物中所含有的原子数为0.4NA
C. 将0.2 mol FeCl3水解制成胶体,所得胶体粒子数为0.2NA
D. 50 mL12 mol/L盐酸与足量MnO2共热,转移电子数为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com