

 ;
; ;
;

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
| A、腌制腊类物质添加大量亚硝酸钠 |
| B、金针菇可用福尔马林浸泡来达到保鲜的目的 |
| C、用NaHCO3发酵面包 |
| D、竹笋用二氧化硫气体漂白 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
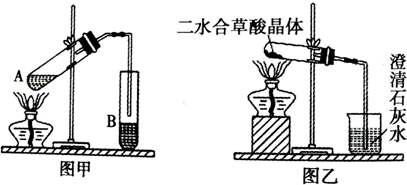
| 175℃ |
| 温度/℃ | 25 | 300 | 350 | 400 | 500 | 600 | 900 |
| 固体质量/g | 1.000 | 0.800 | 0.800 | 0.400 | 0.444 | 0.444 | 0.429 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
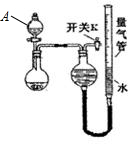
| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu,稀HNO3 | NO | H2O |
| Ⅱ | NaOH(s),浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、NaOH溶液 | H2 | H2O |

| 编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
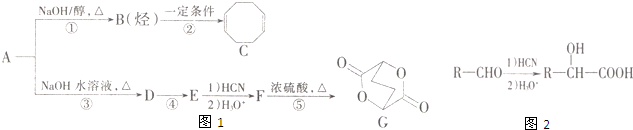
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com