
| A、X最高价氧化物对应的水化物不一定是强酸 | B、X元素的氢化物化学式一定为H2X | C、X的单质一定是良好的半导体材料 | D、X元素的氧化物一定能与烧碱反应 |


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
 已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系符合如图.
已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系符合如图.查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省东莞市高三上学期调研测试理综化学试卷(解析版) 题型:选择题
X是第三周期非金属元素,该原子如果要达到8电子稳定结构,需要的电子数小于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是
A.X最高价氧化物对应的水化物不一定是强酸
B.X元素的氢化物化学式一定为H2X
C.X的单质—定是良好的半导体材料
D.X元素的氧化物—定能与烧碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
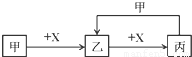
已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系符合下图。

(1)若甲和X均为第二周期元素的常见非金属单质,且乙为直线形分子,则乙的结构式为 ▲ 。
(2)若甲是具有漂白性的酸性氧化物,且X、乙、丙均为强电解质。写出乙和X反应的离子方程式: ▲ ;
(2)若甲为第三周期元素组成的正盐,X是第三周期原子半径最大的元素的氢氧化物,写出甲和丙反应的离子方程式 ▲ 。Ks5u
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省重点中学高三(上)期中化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com