
| A. | 用金属铝进行铝热法炼铁 | B. | 用熟石灰中和土壤的酸性 | ||
| C. | 用NaHCO3治疗胃酸过多 | D. | 用水玻璃制备硅胶和木材防火剂 |
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:填空题
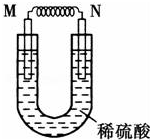 由铜片、铁片和200mL稀H2SO4组成的原电池中(如图),若铁片只发生电化学反应,则当N极上放出2.8L(标准状况)气体时,则M电极材料为Fe,其电极反应式为Fe-2e-=Fe2+,反应结束时,导线上转移电子的物质的量为0.25mol.
由铜片、铁片和200mL稀H2SO4组成的原电池中(如图),若铁片只发生电化学反应,则当N极上放出2.8L(标准状况)气体时,则M电极材料为Fe,其电极反应式为Fe-2e-=Fe2+,反应结束时,导线上转移电子的物质的量为0.25mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
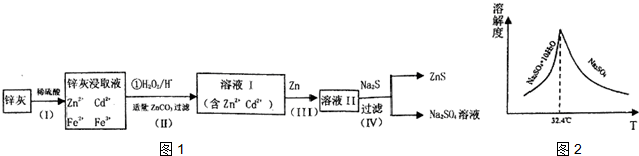
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
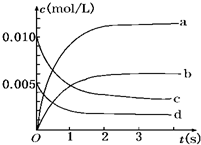 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

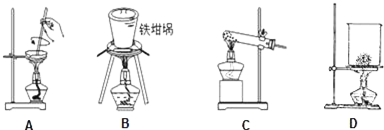
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
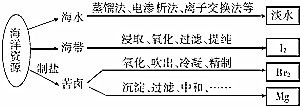
| A. | 从海水中获取淡水,历史最久的方法是离子交换法 | |
| B. | 从海带中获得I2需要用到的主要仪器有蒸发皿、漏斗、烧杯、分液漏斗等 | |
| C. | 用SO2溶液吸收从苦卤中吹出的单质溴时,发生的离子反应是Br2+SO2+2H2O═4H++SO42-+2Br- | |
| D. | 用石灰石、盐酸等从苦卤中提取镁时,发生反应的反应类型有化合、分解、置换和复分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发新能源,减少对化石能源的依赖 | |
| B. | 将燃煤进行脱硫处理,可减少酸雨的形成 | |
| C. | 雾霾(颗粒直径为2.5 x103 nm)具有丁达尔效应 | |
| D. | 推广使用电动汽车,可减少城市雾霾的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
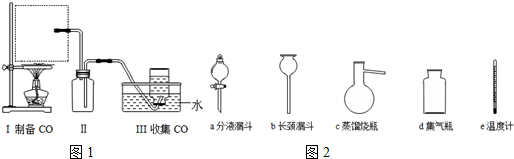
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com