
| ||
| t/min | 0 | 5 | 10 |
| AO/mol?L-1 | 1.00 | 0.65 | 0.50 |
| H2/mol?L-1 | 2.00 | 1.00 | |
| AH3OH/mol?L-1 | 0.00 | 0.35 | 0.50 |
| 3 |
| 12 |
| 0.7 |
| 5 |
| 0.5 |
| 0.5×12 |


科目:高中化学 来源: 题型:
 某校化学兴趣小组拟用浓盐酸与二氧化锰加热反应,制取并收集2瓶干燥.纯净的氯气.为防止换集气瓶时生成的氯气污染空气,设计了如下装置:
某校化学兴趣小组拟用浓盐酸与二氧化锰加热反应,制取并收集2瓶干燥.纯净的氯气.为防止换集气瓶时生成的氯气污染空气,设计了如下装置:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体硅、石墨都属于单质 |
| B、Na2O、Al2O3均为碱性氧化物 |
| C、醋酸、纯碱都属于强电解质 |
| D、水晶、水玻璃都属于盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
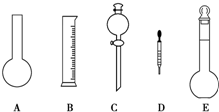 碳酸钙可以降低胃酸的浓度而被用作胃药的抗酸剂.某中学研究性学习小组为测定一胃药中碳酸钙的含量,设计了如下的实验操作:
碳酸钙可以降低胃酸的浓度而被用作胃药的抗酸剂.某中学研究性学习小组为测定一胃药中碳酸钙的含量,设计了如下的实验操作:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 CO和H2作为燃料和化工原料,有着十分广泛的应用.
CO和H2作为燃料和化工原料,有着十分广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:
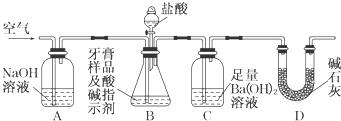
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com