
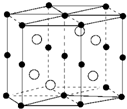
| A. | 锰价电子排布为3d74s0 | B. | Bi是d区金属 | ||
| C. | 该晶体的化学式为MnBi | D. | 该合金堆积方式是简单立方 |
分析 A.Mn为25号元素,其3d、4s电子为其价电子,3d能级有5个电子、4s能级有2个电子;
B.Bi最后排入的电子为p电子;
C.根据原子半径知,黑色小球表示Mn原子、白色小球表示Bi原子,根据均摊法计算原子个数,从而确定化学式;
D.简单立方为六面体.
解答 解:A.Mn为25号元素,其3d、4s电子为其价电子,3d能级有5个电子、4s能级有2个电子,锰价电子排布为3d54s2,故A错误;
B.Bi最后排入的电子为p电子,所以Bi位于p区,故B错误;
C.根据原子半径知,黑色小球表示Mn原子、白色小球表示Bi原子,Bi原子数目为6,Mn原子数目为1+2×$\frac{1}{2}$+12×$\frac{1}{6}$+6×$\frac{1}{3}$=6,故该晶体物质的化学式MnBi,故C正确;
D.简单立方为六面体,根据图知,该合金堆积方式不是简单立方,故D错误;
故选C.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、元素周期表结构、原子核外电子排布、原子堆积方式等知识点,侧重考查学生分析判断及对知识的综合应用,棱上原子被几个晶胞共用是易错点.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:解答题
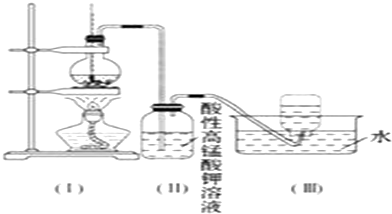
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品包装中的干燥剂必须用特别包装纸包装,其成分多为氧化钙颗粒,也有硅胶颗粒 | |
| B. | 蛋白质、塑料、合成橡胶、光导纤维都是高分子化合物 | |
| C. | Fe2O3、CuO、PbO等金属氧化物是我国古代就已经使用的用于烧碱釉陶的彩色釉面原料 | |
| D. | 控制汽车尾气、工业尾气、建筑扬尘、垃圾焚烧等的任意排放是治理雾霾天气重要环节 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 3:2 | C. | 5:2 | D. | 5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
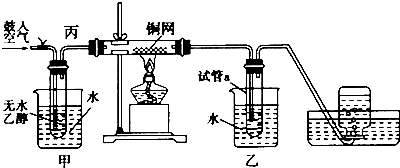
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
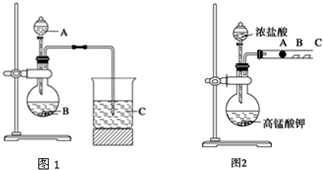
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
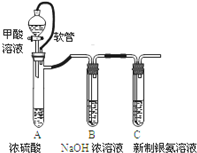 | 已知:①银氨溶液的化学式为: Ag(NH3)2OH ②反应结束后试管C底部有黑色 沉淀生成, ③分离出上层清液和底部黑色 固体备用. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com