
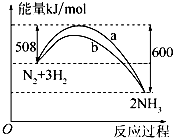
 化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热量的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热量的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.| 1mol×26g/mol |
| 2g |
| 5 |
| 2 |
| 5 |
| 2 |


科目:高中化学 来源: 题型:
 如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题:
如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 绿矾 |
| H |
| 石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 混合物 | 试剂 | 操作 |
| ①SiO2(CaCO3) | ||
| ②SiO2(Si) | ||
| ③NaCl(SiO2) | ||
| ④Mg(Al) | ||
| ⑤Fe2O3(SiO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com