

 Al(OH)3+OH-。
Al(OH)3+OH-。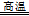 CaSiO3+CO2↑ (3分)
CaSiO3+CO2↑ (3分)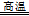 2NaAlO2+CO2↑ (3分)
2NaAlO2+CO2↑ (3分)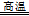 4CO2 + 2Fe2O3(3分)
4CO2 + 2Fe2O3(3分)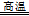 4CO2 + 2Fe2O3;依题意,Na[CuCl2]在水中发生反应V,铜元素由+1部分升高为+2,部分降低为0,则溶液A中含有Cl-、Cu2+和Na+,所以推断A的溶质主要是CuCl2和NaCl;(2)传统方法需要高温煅烧,不仅消耗大量的能量,而且还产生大量的SO2等有毒气体,污染空气,新方法的优点是不会产生SO2污染大气,不用煅烧黄铜矿从而节约热能,可得副产品铁红和硫。
4CO2 + 2Fe2O3;依题意,Na[CuCl2]在水中发生反应V,铜元素由+1部分升高为+2,部分降低为0,则溶液A中含有Cl-、Cu2+和Na+,所以推断A的溶质主要是CuCl2和NaCl;(2)传统方法需要高温煅烧,不仅消耗大量的能量,而且还产生大量的SO2等有毒气体,污染空气,新方法的优点是不会产生SO2污染大气,不用煅烧黄铜矿从而节约热能,可得副产品铁红和硫。

科目:高中化学 来源:不详 题型:单选题
| | 物质 | 选用试剂(过量) | 操作方法 |
| A | Cu(CuO) | 氧气 | 通入氧气并加热 |
| B | CO2(HCl) | 饱和碳酸氢纳溶液 | 通过盛有饱和碳酸氢纳溶液的洗气瓶 |
| C | CO(H2) | 氧化铜 | 通过灼热的氧化铜 |
| D | KCl溶液(K2CO3) | 氯化钙溶液 | 加入氯化钙溶液充分反应后过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入氨水,产生白色沉淀,证明原溶液中存在Al3+ |
| B.加入AgNO3溶液,产生白色沉淀,证明原溶液中存在Cl- |
| C.加入盐酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中存在SO42- |
| D.加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中存在NH4+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
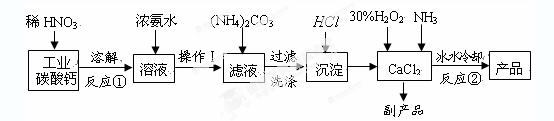
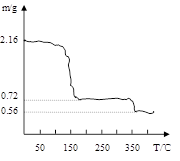
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
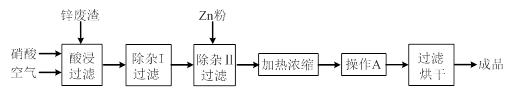
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
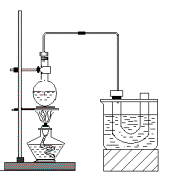
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
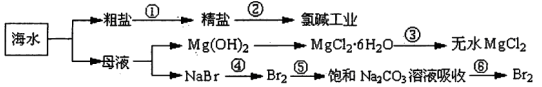
| A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B.第②步中工业上可采用石墨为阴极,铁为阳极,采用阳离子交换膜的电解装置 |
| C.第③步中结晶出的MgCl2·6H2O可在空气中受热分解制无水MgCl2 |
| D.在第④步中溴元素被氧化,第⑤、⑥步中既有溴元素被氧化也有溴元素被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
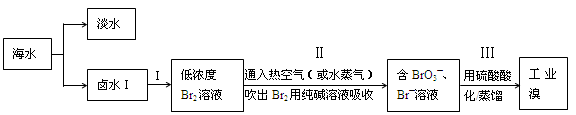
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com