
| n |
| V |


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
| W | 单质是淡黄色固体 | ||
| X | 第三周期原子半径最小的金属 | ||
| Y | 单质不能将比它不活泼的金属从盐溶液中置换出来 | ||
| Z | 原子最外层电子数是电子总数的
|
| A、Y、X、W的原子半径依次减小,其单核离子的半径按X、Y、W的顺序依次增大 |
| B、W、X、Y的最高价氧化物的水化物之间可以两两反应 |
| C、Y的氧化物与Z的最高价氧化物反应一定是氧化还原反应 |
| D、W、Z、X、Y的最高正价依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
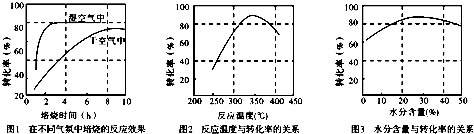
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
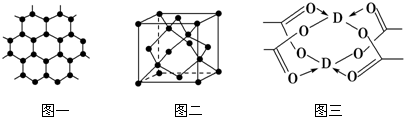
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 臭氧是一种强氧化剂,常用于消毒、灭菌等.
臭氧是一种强氧化剂,常用于消毒、灭菌等.| pH t/min T/℃ |
3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与AlCl3溶液发生反应的离子方程式为:Al3++3OH-=Al(OH)3↓ |
| B、加水稀释后,溶液中c(H+)变小 |
| C、其溶液的pH=13 |
| D、加入少量冰醋酸,溶液导电性增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com