
【题目】一定温度下,在2L的恒容密闭容器中发生反应A(g)+2B(g)![]() 3C(g)。反应过程中的部分数据如下表所示:
3C(g)。反应过程中的部分数据如下表所示:
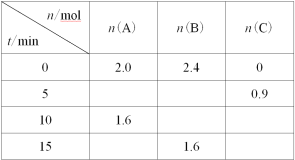
下列说法正确的是( )
A.0~5min用A表示的平均反应速率为0.09mol·L1·min1
B.该反应在10min后才达到平衡
C.平衡状态时,c(C)=0.6mol·L1
D.物质B的平衡转化率为20%
【答案】C
【解析】
发生的反应为:
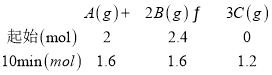
15min时,n(B)=1.6mol,与10min时数据一致,说明反应已经达到平衡,据此逐项分析。
A.0~5 min内,△n(C)=0.9mol,根据方程式,则△n(A)=![]() △n(C)=0.3mol,所以用A表示的平均反应速率为v(A)=
△n(C)=0.3mol,所以用A表示的平均反应速率为v(A)=![]() =
=![]() =
=![]() =0.03mol/(Lmin),选项A错误;
=0.03mol/(Lmin),选项A错误;
B.反应在10min时,B变化了0.8mol,则此时B余下1.6mol,到15min时,B仍然是1.6mol,说明反应在10min已经达到平衡,选项B错误;
C.15min时,n(B)=1.6mol,与10min时数据一致,说明反应在10min已经达到平衡,则平衡时,c(C)=![]() =0.6mol/L,选项C正确;
=0.6mol/L,选项C正确;
D.物质B的转化率为α(B)=![]() ×100%=33.3%,选项D错误;
×100%=33.3%,选项D错误;
答案为A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示的转化关系。根据图示转化关系推测下列说法正确的是

A.可用淀粉-KI试纸和食醋检验加碘盐中是否含有碘元素
B.向淀粉-KI溶液中通入过量Cl2,最终溶液呈蓝色
C.由图可知氧化性的强弱顺序为C12 >I2 >IO3-
D.途径1和II中各自生成1 mol I2,反应中转移的电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① X、Y、Z、W、R、Q为原子序数依次增大的短周期元素。X 是所有元素中原子半径最小的元素,Y是形成化合物种类最多的元素,W的最外层电子数是次外层电子数的3倍,Q与W同主族,Y、R原子的最外层电子数之和等于Z的最外层电子数。
②莱纳斯·卡尔·鲍林在1932年提出electronegativity作为元素原子在化合物某种性质的标度,electronegativity的大小可以判断元素金属性与非金属性强弱,下表列出部分短周期元素的Electronegativity的值。
元素 | X | Y | Z | W | R | Q |
electronegativity | 2.1 | 2.5 | 3.0 | 3.5 | 0.9 | 2.5 |
元素 | Mg | Li | Al | Cl | P | Be |
electronegativity | 1.2 | 1.0 | 1.5 | 3.0 | 2.1 | 1.5 |
请回答下列问题(涉及X、Y、Z、W、R、Q时,用元素符号表示):
(1)根据上表给出的数据,可知元素的electronegativity越大,__(填“金属性”或“非金属性”)越强。
(2)元素Q在周期表中的位置为_________。
(3)W、R、Q单核简单离子半径由大到小排列顺序为______。
(4)元素X、Z、W之间能形成多种10电子微粒,请写出反应物和产物均为X、Z、W之间形成的10电子微粒的一个离子方程式______________。
(5)一种由元素W、R组成的白色固体化合物,其电子式为_______________。
(6)试比较稳定性:X2W_____ X2Q;沸点:X2W_____ X2Q (填“<”或“>”)。
(7)元素 X、Y、Z、W、R、Q中的两种元素可形成原子个数比为1∶2的共价化合物,则这两种元素的原子序数之差不可能是_________。
A.2 B.4 C.5 D.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学实验中,通常利用如图所示的装置进行喷泉实验,来验证气体的“溶解性”,下列有关说法不正确的是
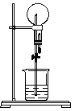
A.用滴管加入液体后,由于气体的“溶解”,使瓶内压强减小,导致瓶内压强小于外界压强,从而形成喷泉
B.选用合适的溶液,CO2也能做喷泉实验
C.HCl、NH3和SO2均能用该装置做喷泉实验
D.用NO2气体做喷泉实验,烧瓶中将充满稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油酸甘油酯和硬脂酸甘油酯均是天然油脂的成分。 它们的结构简式如下图所示。

下列说法错误的是
A. 油酸的分子式为C18H34O2
B. 硬脂酸甘油酯的一氯代物共有54种
C. 天然油脂都能在NaOH溶液中发生取代反应
D. 将油酸甘油酯氢化为硬脂酸甘油酯可延长保存时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-764.5kJ·mol-1,达到平衡后,为提高反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+2CO2(g) △H=-764.5kJ·mol-1,达到平衡后,为提高反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度
B.升高温度同时充入氮气
C.加催化剂同时增大压强
D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A. 17 g羟基(—OH)所含有的电子数是10NA个
B. 1 mol苯乙烯中含有的碳碳双键数为4NA个
C. 常温下,14 g乙烯和丙烯的混合物中总原子数为3NA个
D. 4.2 g C3H6中含有的碳碳双键数一定为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氰基丙烯酸酯是一种用途广泛且具有粘性的材料,其合成原理如图:
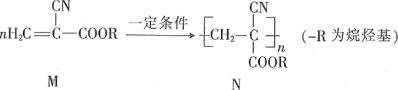
已知:RCN在一定条件下,发生水解反应,其产物为RCOOH和NH3。
下列说法正确的是
A.M能使酸性高锰酸钾溶液褪色,不能使溴水褪色
B.上述反应类型是缩聚反应
C.1molM的水解产物最多消耗1molNaOH
D.若R为甲基,N的平均相对分子质量为11100,则n=100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二草酸合铜(II)酸钾晶体{K2[Cu(C2O4)2]·2H2O}(其相对式量为354),是一种工业用化工原料。微溶于冷水,可溶于热水,微溶于酒精,干燥时较为稳定,加热时易分解。现以胆矾和草酸为原料制备二草酸合铜( II)酸钾晶体流程如下:

(已知:H2C2O4![]() CO↑十CO2↑+H2O)
CO↑十CO2↑+H2O)
请回答:
(1)第①步操作要微热溶解,其原因是加快溶解速率和________。
(2)为了将滤纸上的黑色固体充分转移到热的KHC2O4溶液中,以下操作方案中最合理的是______。
A.用水溶解滤纸上的黑色固体,然后将溶液转入热的KHC2O4溶液中
B.用硫酸溶液溶解滤纸上的氧化铜,然后转入热的KHC2O4溶液中
C.黑色固体连同滤纸一起加入到热的KHC204溶液中,待充分反应后趁热过滤
D.先将黑色固体转入溶液中,再在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液中
(3)50℃水浴加热至反应充分,写出该反应的化学方程式___________。
(4)步骤③所用的洗涤剂最合适的是_______。
(5)二草酸合铜(II)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;b.________ 。
②在蒸发浓缩的初始阶段可通过_______(填操作名称)回收乙醇。
(6)准确称取制取的晶体试样l.000g溶于NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL于锥形瓶中,再加入l0mL 3.000mol/L的H2SO4溶液,用0.01000mol/L的KMnO4溶液滴定,消耗KMnO4标准液20.00mL,则该产品的纯度是_______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com