


| 0.162×0.162 |
| 0.02×0.02 |


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
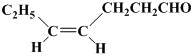 )不溶于水,是一种昂贵的食用香料,也是重要的医药中间体.M的一条合成路线如下(部分反应试剂和条件略去),且D与M互为同分异构体.
)不溶于水,是一种昂贵的食用香料,也是重要的医药中间体.M的一条合成路线如下(部分反应试剂和条件略去),且D与M互为同分异构体.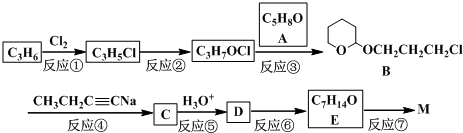
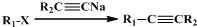
| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①、④等体积混合后,溶液显碱性 |
| B、将②、③溶液混合后,pH=7,消耗溶液的体积:②>③ |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量①最大 |
| D、向溶液中加入100 mL水后,溶液的pH:③>④>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).查看答案和解析>>
科目:高中化学 来源: 题型:
 关于该有机物说法不正确的是( )
关于该有机物说法不正确的是( )| A、能发生加成、取代、加聚反应 |
| B、1 mol该有机物最多可以与3 mol NaOH反应 |
| C、既可以使溴水褪色,又可以使酸性KMnO4溶液褪色 |
| D、既可以发生消去反应,又可以与NaHCO3溶液反应放出CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、回收石墨电极 |
| B、防止电池中渗泄的电解液腐蚀其他物品 |
| C、回收电池外壳的金属材料 |
| D、防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Na>Mg>O |
| B、还原性:F->Cl->S2- |
| C、酸性:H3PO4>H2SO4>HClO4 |
| D、稳定性:H2O>HF>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自行车钢架生锈主要是电化学腐蚀所致 |
| B、利用垃圾发电能达到节能减排的目的 |
| C、人们用明矾对水进行消毒、杀菌 |
| D、食用一定量的油脂能促进人体对某些维生素的吸收 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com