
【题目】氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:
CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是
A. 既不是氧化剂也不是还原剂
B. 是氧化剂
C. 是还原剂
D. 既是氧化剂又是还原剂
科目:高中化学 来源: 题型:
【题目】常温下,将pH=11的X、Y两种碱溶液,分别从1 mL稀释至100 mL,其pH与溶液体积(V)的变化关系如图,下列说法正确的是
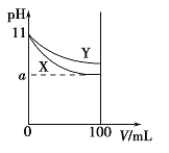
A.稀释前,X、Y中溶质碱的物质的量浓度相等
B.稀释后,X溶液的碱性比Y溶液的碱性强
C.同浓度盐酸分别与X、Y这两种碱溶液恰好完全反应时,消耗盐酸的体积V(X)>V(Y)
D.若a>9,则X和Y都为弱碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法正确的是( )
A. 胆矾、石膏、漂白粉都是纯净物
B. 氢氧化钙、盐酸、硫酸铜均为强电解质
C. 氯化钙、烧碱、聚苯乙烯均为化合物
D. 稀豆浆、鸡蛋清溶液、雾均为胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对物质的分类正确的是( )
A. SO2、NH3属于电解质
B. 海水、氢氧化铁胶体属于纯净物
C. H2SO4、HNO3属于化合物
D. 烧碱、纯碱属于碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g)![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,反应速率增大,平衡向逆反应方向移动
③压缩容器增大压强,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①② B.② C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.为减少碳排放,科学家提出利用CO2和H2反应合成甲醇,其反应原理为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
(1)上述反应常用CuO和ZnO的混合物作催化剂。经研究发现,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率有明显影响。实验数据如表所示:

根据数据表判断,催化剂中CuO的最佳质量分数为________。
(2)已知:①CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH1=-41 kJ·mol-1;
CO2(g)+H2(g) ΔH1=-41 kJ·mol-1;
②CO(g)+2H2(g)===CH3OH(g) ΔH2=-91 kJ·mol-1。
写出由CO2和H2制备甲醇蒸气并产生水蒸气的热化学方程式:______________________________。
(3)甲醇是清洁能源。某甲醇燃料电池的电解质为稀硫酸,其能量密度为5.93 kW·h·kg-1。该电池的负极反应式为______________。若甲醇的燃烧热为ΔH=-726.5 kJ·mol-1,该电池的能量利用率为________(结果精确到小数点后1位数字)。(已知1 kW·h=3.6×106 J)
Ⅱ.利用CO和H2在催化剂的作用下合成甲醇,发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示。现有两个体积相同的恒容密闭容器甲和乙,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 mol H2,测得不同温度下CO的平衡转化率如图2所示。
CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示。现有两个体积相同的恒容密闭容器甲和乙,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 mol H2,测得不同温度下CO的平衡转化率如图2所示。
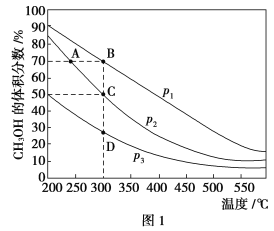
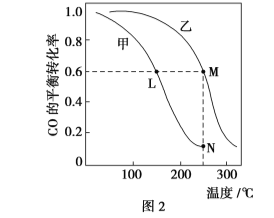
(1)该反应的ΔH________(填“>”、“<”或“=”,后同)0,p1________p2。
(2)达到平衡时,反应速率:A点________B点。平衡常数:C点________D点。
(3)在C点时,CO的转化率为________。
(4)L、M两点容器内压强:p(M)________2p(L)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com