
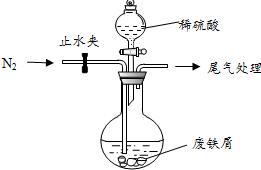
 绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:分析 I.氧化铜、氧化铁与硫酸反应生成硫酸铜和硫酸铁,铁单质与硫酸铜和硫酸铁反应生成硫酸亚铁和铜单质.
(1)碳酸钠的水溶液显碱性,可以除去铁屑表面的油污;
(2)FeSO4易被氧气氧化;
(3)氧化铜、氧化铁与硫酸反应生成硫酸铜和硫酸铁,铁单质与硫酸铜和硫酸铁反应生成硫酸亚铁和铜单质;
(4)过滤,冷却结晶可得FeSO4•7H2O晶体;
II.(1)根据配制溶液的步骤以及每步操作需要仪器确定反应所需仪器;
(2)可利用KMnO4溶液自身的颜色作为指示剂判断滴定终点;
(3)Fe2+→Fe3+,铁元素化合价升高1价;MnO4-→Mn2+,锰元素降低5价,化合价升降最小公倍数为5,根据关系式5Fe2+~MnO4-,计算25mL该液体中Fe2+的物质的量,进而计算样品中FeSO4•7H2O的质量,再根据质量分数定义计算;
(4)定容时仰视体积偏大.
解答 解:I.(1)碳酸钠的水溶液显碱性,可以除去铁屑表面的油污,故答案为:洗去铁屑表面的油污;
(2)FeSO4易被氧气氧化,持续通入N2排除装置中的空气或氧气,故答案为:排除装置中的空气或氧气;
(3)氧化铜、氧化铁与硫酸反应生成硫酸铜和硫酸铁,铁单质与硫酸铜和硫酸铁反应生成硫酸亚铁和铜单质,故答案为:Cu;
(4)洗涤、过滤、冷却结晶可得FeSO4•7H2O晶体,故答案为:冷却结晶;
II.(1)步骤为:计算→称量→溶液→转移→洗涤→定容→摇匀→装瓶→贴签,需要使用的仪器有:100mL 容量瓶,托盘天平、烧杯、玻璃棒、胶头滴管,量筒可用可不用,故答案为:100mL 容量瓶、玻璃棒;
(2)可利用KMnO4溶液自身的颜色作为指示剂判断滴定终点时,再滴加KMnO4溶液时,溶液将由无色变为紫红色,
故答案为:当最后一滴标准液滴入时,溶液变为紫红色,且30s保持不变;
(3)测定样品中Fe2+的含量,采用在酸性条件下KMnO4标准液滴定,Fe2+→Fe3+,铁元素化合价升高1价;MnO4-→Mn2+,锰元素降低5价,化合价升降最小公倍数为5,故Fe2+系数为5,MnO4- 系数为1,根据元素守恒可知Mn2+与Fe3+系数分别为1、5,根据电荷守恒可知缺项为H+,H+其系数为2+3×5-[2×5-1]=8,根据H元素守恒可知H2O系数是4,所以反应离子方程式为5Fe2++MnO4-+8H+=1Mn2++5Fe3++4H2O,
令Fe2+的物质的量为xmol,则:
5Fe2+~~~~~~MnO4-,
5 1
xmol 0.01L×0.1mol/L
所以x=$\frac{0.01×0.1mol/L×5}{1}$=0.005mol,
所以样品中FeSO4•7H2O的质量0.005mol×4×278g/mol=5.56g,所以4g产品中FeSO4•7H2O的质量分数为$\frac{5.56g}{10g}$×100%=55.6%,
故答案为:55.6%;
(4)定容时仰视体积偏大,浓度偏小,故答案为:仰视.
点评 本题考查物质的制备与含量的测定,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g D2O和18 g H2O中含有的质子数均为10NA | |
| B. | 1 mol Cu和2mol热的浓硫酸反应可生成NA个SO2分子 | |
| C. | 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| D. | 标准状况下,22.4 L N2和H2混合气中含NA个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 每生成2molAB吸收b kJ热量 | |
| B. | 该反应热△H=(b-a)kJ•mol-1 | |
| C. | 该反应为吸热反应 | |
| D. | 断裂1 mol A-A和1 mol B-B键放出a kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com